-
化学与生活、科技、医药、工业生产均密切相关,下列有关化学叙述正确的是( )
A. 浓硫酸具有强腐蚀性,可用浓硫酸刻蚀石英制艺术品
B. 我国预计2020年发射首颗火星探测器太阳能电池帆板的材料是二氧化硅
C. 《本草经集注》中关于鉴别硝石(KNO3)和朴硝(Na2SO4)的记载:“以火烧之,紫青烟起,乃真硝石也”,该方法应用了焰色反应
D. 误食重金属盐引起的人体中毒,可喝大量的食盐水解毒
难度: 中等查看答案及解析
-
X、Y、Z、W、R为原子序数依次增大的五种短周期主族元素,X原子的最外层电子数是其内层电子数的2倍,W+与Y2 ─具有相同的电子层结构,R与Y可形成RY2、RY3化合物,下列说法正确的是
A. Y与氢元素所形成的化合物分子只含有极性键
B. W2Y、W2Y2中阴、阳离子个数比均为1:2
C. Z的最高价氧化物对应水化物的酸性比R的强
D. 将XY2通入W单质与水反应后的溶液中,生成的盐只有一种
难度: 中等查看答案及解析
-
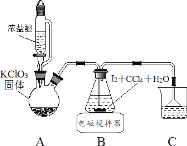
下列装置应用于实验室制氯气并回收氯化锰的实验,能达到实验目的的是

A.用装置甲制取氯气
B.用装置乙除去氯气中的少量氯化氢
C.用装置丙分离二氧化锰和氯化锰溶液
D.用装置丁蒸干氯化锰溶液制MnCl2·4H2O
难度: 中等查看答案及解析
-
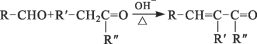
25 ℃时:有 c(CH3COOH)+c(CH3COO-)=0.1 mol·L-1的一组醋酸、醋酸钠混合溶液,溶液中 c(CH3COOH)、c(CH3COO-)与 pH 的关系如图所示,下列有关溶液中离子浓度的叙述正确的是( )
A.pH=3.5 的溶液中:c(Na+)+c(H+)—c(OH-)+c(CH3COOH)=0.1 mol·L-1
B.W 点所表示的溶液中:c(Na+)+c(H+)>c(CH3COOH)+c(OH-)
C.pH=5.5 的溶液中:c(CH3COOH)>c(CH3COO-)>c(H+)>c(OH-)
D.向 W 点所表示的 1.0 L 溶液中通入 0.05 mol HCl 气体(溶液体积变化可忽略):c(H+)=c(CH3COOH)+c(OH-)
难度: 中等查看答案及解析
-
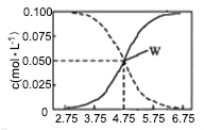
下列示意图与对应的反应情况正确的是
A.含0.01molKOH 和0.01mol Ca(OH)2的混合溶液中缓慢通入CO2
B.KAl(SO4)2溶液中逐滴加入Ba(OH)2溶液
C.n(O2)=1mol时,高温下C和O2在密闭容器中的反应产物
D.n(NaOH)=1mol时,CO2和NaOH溶液反应生成的盐
难度: 困难查看答案及解析
-
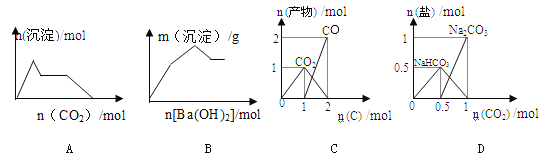
高铁电池具有比能量高、无污染的特点,用下图模拟其工作原理(放电时两电极均有稳定的金属氢氧化物生成),下列有关说法中正确的是( )
A.放电时,电子由正极通过外电路流向负极
B.放电时,负极上的电极反应式为:Zn—2e-+2H2O=Zn(OH)2+2H+
C.充电时,阴极区溶液的pH减小
D.充电时,阳极上的电极反应式为:Fe(OH)3—3e-+5OH-=FeO4 2-+4H2O
难度: 中等查看答案及解析
-
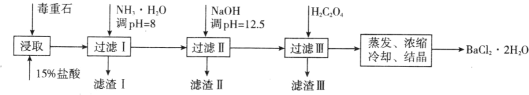
球墨铸铁中含有一种铁碳化合物X。实验小组为测定化合物X的组成设计实验如下:
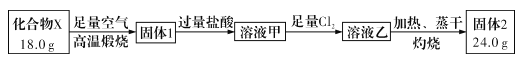
下列说法不正确的是
A.固体2是氧化铁
B.X的化学式可以表示为Fe3C2
C.将溶液甲在空气中加热、蒸干、灼烧也可得到24.0g固体
D.X与足量的热浓硝酸反应有NO2和CO2生成
难度: 中等查看答案及解析