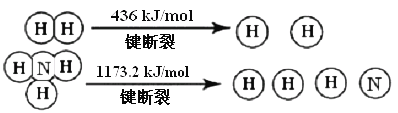
-
有X、Y、Z三种物质。常温下分别用Y或Z与X混合时,反应速率几乎相同的是
选项
X
Y
Z
A
2mL 5%H2O2 溶液
MnO2
1mL 1 mol·L-1FeCl3溶液
B
1mL 1 mol·L-1 NaHCO3溶液
1 mL 1 mol·L-1 HCl溶液
1mL 0.5 mol·L-1 H2SO4溶液
C
钠块
10 mL 乙醇
10 mL 水
D
经过酸洗除锈的铁钉
5mL 海水
5 mL 蒸馏水
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
已知:①H2O(g)=H2O(l) ΔH1=-Q1kJ·mol-1(Q1>0)
②C2H5OH(g)=C2H5OH(l) ΔH2=-Q2kJ·mol-1(Q2>0)
③C2H5OH(g)+3O2(g)=2CO2(g)+3H2O(g) ΔH3=-Q3kJ·mol-1(Q3>0)
若使23 g液态乙醇完全燃烧,最后恢复到室温,则放出的热量(kJ)为( )
A.Q1+Q2+Q3 B.0.5(Q1+Q2+Q3)
C.0.5Q1-1.5Q2+0.5Q3 D.1.5Q1-0.5Q2+0.5Q3
难度: 中等查看答案及解析
-
在温度t1和t2下,X2(g)和H2反应生成HX的平衡常数如下表
化学方程式
K(t1)
K(t2)
F2+H2
2HF
1.8×1036
1.9×1032
Cl2+H2
2HCl
9.7×1012
4.2×1011
Br2+H2
2HBr
5.6×107
9.3×106
I2+H2
2HI
43
34
根据K的变化,结合已有知识推测,随着卤素原子核电荷数的降低,下列说法不正确的是
A.在相同条件下,平衡时X2的转化率逐渐升高
B.X2与H2反应的剧烈程度逐渐减弱
C.HX的还原性逐渐减弱
D.HX的生成为放热反应,由此可知t1<t2
难度: 中等查看答案及解析
-
在体积可变的密闭容器中发生反应:CO(g) + H2O(g) ⇌ CO 2 (g) + H2O(g)(正反应为放热反应),改变下列条件,不能使ν正 增大的是
A. 升高温度 B. 恒容充He
C. 缩小容器体积 D. 恒容时充入更多的H2O(g)
难度: 中等查看答案及解析
-
某反应使用催化剂后,其反应过程中的能量变化如图,下列说法错误的是( )
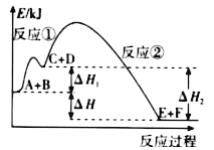
A.总反应为放热反应 B.使用催化剂后,活化能不变
C.反应①是吸热反应 D.△H=△H1+△H2
难度: 中等查看答案及解析
-
下列说法正确的是
A.在其他外界条件不变的情况下,增大压强能增大活化分子的百分数
B.NH4Cl(s)=NH3(g)+HCl(g)室温下不能自发进行,说明该反应的△H <0
C.加入合适的催化剂能降低反应活化能,从而改变反应的焓变
D.常温下,Ksp[Al(OH)3]=1×10-33。欲使溶液中c(Al3+)≤ 1×10-6 mol/L,需调节溶液的pH≥5
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.升高温度,只能增大吸热反应的反应速率
B.对于任何反应,增大压强都可加快反应速率
C.使用正催化剂,能增大活化分子百分数,所以反应速率增大
D.增大反应物浓度,能增大活化分子百分数,所以反应速率增大
难度: 简单查看答案及解析
-
下列叙述正确的是:
①热稳定性:H2O>HF>H2S
②熔点:Al>Na>K
③IA、IIA族元素的阳离子与同周期稀有气体元素的原子具有相同的核外电子排布
④结合质子(H+)能力:CO32﹣>HCO3﹣>SO42﹣
⑤同一主族的元素的氢化物,相对分子质量越大,它的沸点一定越高
⑥已知2H2(g)+O2(g)=2H2O(1);△H=﹣571.6kJ•mol﹣1,则氢气的燃烧热为285.8kJ•mol﹣1,
⑦因为常温下白磷可自燃,而氮气须在放电时才与氧气反应,所以非金属性:P>N( )
A.②③④ B.①⑥⑦ C.②④⑥ D.③⑤⑦
难度: 中等查看答案及解析
-
在密闭容器中进行反应:X(g)+3Y(g)
2Z(g),有关下列图像的说法错误的是
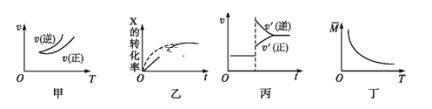
A.依据图甲可判断正反应为放热反应
B.在图乙中,虚线可表示使用了催化剂
C.若正反应的ΔH<0,图丙可表示升高温度使平衡向逆反应方向移动
D.由图丁中气体平均相对分子质量随温度的变化情况,可推知正反应的ΔH>0
难度: 中等查看答案及解析
-
可逆反应
达到平衡后,通入
,再次达到平衡时
存在于
A.
和
B.
和
C.
、
和
D.
和
难度: 简单查看答案及解析
-
下列事实能用勒夏特列原理解释的是
A. 工业制硫酸在二氧化硫催化氧化时采用高温来提高单位时间SO3的产量
B. 合成氨工业中使用铁触媒做催化剂来加快反应速率
C. 用饱和食盐水来除去氯气中氯化氢杂质
D. 对于2HI(g)
H2(g)+I2(g),达平衡后,缩小容器体积可使体系颜色变深
难度: 中等查看答案及解析
-
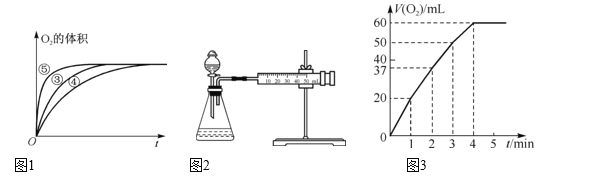
一定温度下,10mL 0.40 mol·L-1H2O2溶液发生催化分解。不同时刻测得生成O2的体积(已折算为标准状况)如下表。
t/min
0
2
3
6
8
10
V(O2)/mL
0.0
9.9
17.2
22.4
26.5
29.9
下列叙述不正确的是( )(溶液体积变化忽略不计)
A. 反应至6min时,H2O2分解了50%
B. 反应至6min时,c(H2O2)=0.20 mol·L-1
C. 0~6min的平均反应速率:v(H2O2)≈3.3×10-2mol/(L·min)
D. 4~6min的平均反应速率:v(H2O2)>3.3×10-2mol/(L·min)
难度: 中等查看答案及解析
-
下列热化学方程式书写正确的是:
A.2SO2+O2
2SO3 ΔH=-196.6 kJ·mol-1
B.H2(g)+
O2(g)=H2O(l) ΔH=-285.5 kJ·mol-1
C.2H2(g)+O2(g)=2H2O(l) ΔH=-571.6 kJ
D.C(s)+O2(g)=CO2(g) ΔH=+393.5 kJ·mol-1
难度: 简单查看答案及解析
-
下列说法正确的是
A. 温度、浓度、压强、催化剂均能改变平衡常数
B. 升高温度,平衡常数一定增大
C. 平衡常数变化,化学平衡不一定发生移动
D. 化学平衡发生移动,平衡常数不一定改变
难度: 简单查看答案及解析
-
在t℃下,某反应达到平衡,平衡常数K=
。恒容时,温度升高时NO浓度减小。下列 说法正确的是
A.该反应的焓变为正值
B.若恒温下增大压强(缩小体积),则反应体系的颜色加深
C.在t℃时,加入催化剂,该反应的化学平衡常数增大
D.该反应化学方程式为NO+SO3
NO2+SO2
难度: 中等查看答案及解析
-
在一体积2L的密闭容器中加入反应物N2、H2,发生如下反应:N2(g)+3H2(g)
2NH3(g)。反应过程中的部分数据如下表所示,下列说法正确的是
物质的量/ mol
时间/min
n(N2)
n(H2)
n(NH3)
0
1.0
1.2
0
2
0.9
4
0.75
6
0.3
A. 0~2 min内,NH3的反应速率为0.1 mol·Lˉ1·minˉ1
B. 2 min时, H2的物质的量0.3 mol
C. 4 min时,反应已达到平衡状态,此时正、逆反应的速率都为0
D. 4~6 min内,容器内气体分子的总物质的量不变
难度: 困难查看答案及解析
-
在铁粉和过量2mol/L的稀H2SO4反应中,下列各措施能加快的速率,但又不影响H2的总量的是( )
A.加入少量的CuSO4溶液 B.将2mol/L的稀硫酸改成98%的浓硫酸
C.将铁粉改为铁片 D.加热
难度: 中等查看答案及解析
-
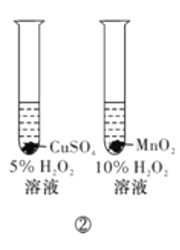
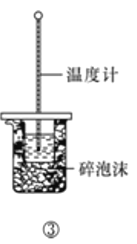
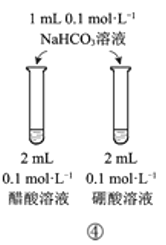
下列实验方案中,能达到相应实验目的的是
A.方案①用于分离I2和NH4Cl固体
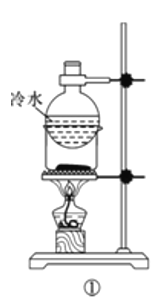
B.方案②用于比较CuSO4和MnO2的催化活性
C.方案③用于测定中和热
D.方案④用于比较醋酸和硼酸的酸性强弱
难度: 简单查看答案及解析
-
将一定量纯净的氨基甲酸铵固体置于恒容的密闭真空容器中,在恒定温度下使其达到分解平衡:NH2COONH4(s)
2NH3(g)+CO2(g),实验测得不同温度下的平衡数据列于下表:
温度/℃
15
20
25
30
35
平衡总压强/kPa
5.7
8.3
12.0
17.1
24.0
平衡气体总浓度/ 10-3mol·L-1
2.4
3.4
4.8
6.8
9.4
下列说法正确的是
A. 该反应在低温下可以自发进行
B. 当体系中气体的平均相对分子质量不变时,说明该反应达到了平衡状态
C. 恒温条件下,向容器中再充入2mol NH3和1molCO2,平衡向左移动,平衡后,NH3的浓度减小
D. 15℃时,该反应的平衡常数约为2.05×10-9
难度: 中等查看答案及解析
-
汽车尾气中NO产生的反应为:N2(g)+O2(g)
2NO(g),一定条件下,等物质的量的N2(g)和O2(g)在恒容密闭容器中反应,如图曲线a表示该反应在温度T下N2的浓度随时间的变化,曲线b表示该反应在某一起始反应条件改变时N2的浓度随时间的变化。下列叙述不正确的是( )
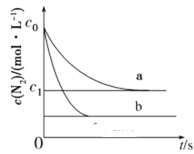
A.温度T下,该反应的平衡常数
B.温度T下,随着反应的进行,混合气体的密度不变
C.曲线b对应的条件改变可能是增大压强
D.若曲线b对应的条件改变是温度,可判断该反应的ΔH>0
难度: 困难查看答案及解析