-
《抱朴子内篇》中记载:丹砂(HgS)烧之成水银,积变又还成丹砂。若上述过程在密封条件下进行,下列说法不正确的是
A.“丹砂”的主要成分HgS是离子化合物
B.“丹砂烧之成水银”过程中发生反应:HgS+O2
Hg +SO2
C.整个过程中发生的氧化还原反应有2个
D.“积变又还成丹砂”的反应在常温下就能发生
难度: 简单查看答案及解析
-
已知:三元轴烯
(a)、四元轴烯
(b)、五元轴烯
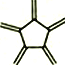 (c)的最简式都与苯相同,下列说法不正确的是
(c)的最简式都与苯相同,下列说法不正确的是A.三种物质都能发生加成反应 B.a、b分子中所有原子都在同一个平面上
C.a与
互为同分异构体 D.a、b的一氯代物均只有一种,c的一氯代物有三种
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。下列说法正确的是
A.标准状况下,22.4 LCl2通入到水中,则N(HClO)+N(Cl-)+N(ClO-)=2NA
B.足量过氧化钠与1mol CO2反应,转移电子的数目为2NA
C.44g乙醛和乙酸乙酯组成的混合物中含有的氢原子数目为4NA
D.32.5g锌与一定量浓硫酸恰好完全反应,生成的气体分子数小于0.5NA
难度: 中等查看答案及解析
-
室温条件下,用0.100 mol/L的NaOH溶液分别滴定酸HX、HY、HZ,三种酸的体积均为20.00 mL,浓度均为0.100 mol/L,滴定曲线如图所示。下列叙述正确的是
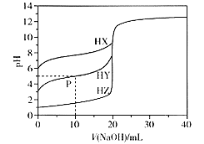
A.电离常数Ka(HX)的数量级为10-12
B.P点对应的溶液中:c(Y-) >c(Na+) >c(HY)>c(H+)>c(OH-)
C.pH=7时,三种溶液中c(X-) =c(Y-)=c(Z-)
D.HX的电离程度大于X-的水解程度
难度: 中等查看答案及解析
-
由下列实验及现象推出的相应结论正确的是
选项
实验
现象
结论
A
2 mL0.01mol·L-1的KI溶液中滴入等体积等浓度的FeCl3溶液,将充分反应后的溶液分三份,一份滴入K3[Fe(CN)6]溶液,第二份滴入KSCN溶液,第三份滴入淀粉溶液
滴入K3[Fe(CN)6]溶液后产生蓝色沉淀;滴入KSCN溶夜后变血红色;滴入淀粉溶液后溶液变蓝
KI溶液和FeCl3溶液发生反应:2Fe3++2I-
2Fe2++I2
B
向稀硫酸中加入铜片,然后通入氧气加热
先无明显现象,通入氧气加热后溶液变蓝
氧化性:稀硫酸>Cu2+
C
向浓度均为0.1 mol·L-1的Na2SO3和Na2SiO3溶液中分别滴加酚酞
Na2SiO3溶液红色更深
非金属性:Si<S
D
将几滴等浓度的FeCl3溶液、AlCl3溶液同时滴入足量等浓度的NaOH溶液中
只产生红褐色沉淀
Ksp[Al(OH)3]>Ksp[Fe(OH)3]
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
四种短周期元素X、Y、Z、W的最外层电子数之和为16,其中X、Y、Z的电子层数相同,W原子的核外电子层数与其他三种不同,X元素的焰色反应呈黄色,Y元素能形成多种单质,其中一种单质在空气中易自燃,Z元素的最外层电子数是K层的2倍。下列推断正确的是( )
A.原子半径:X<Y
B.简单离子半径:W>X>Y
C.Z和W形成的化合物和某些酸、强碱均能发生反应
D.X、Y、W和氢元素形成的化合物的水溶液一定呈碱性
难度: 简单查看答案及解析
-
25℃时,NH4+的水解平衡常数为Kb=5.556×10-10。该温度下,用0.100 mol·L-1的氨水滴定10.00mL 0.050 mol·L-1的二元酸H2A的溶液,滴定过程中加入氨水的体积(V与溶液中lg
的关系如图所示。下列说法正确的是

A.H2A的电离方程式为H2A
H++A2-
B.25℃时,Kb(NH3·H2O)=1.8×10-5
C.P点时加入氨水的体积为10 mL
D.向H2A溶液中滴加氨水的过程中,水的电离程度逐渐减小
难度: 困难查看答案及解析


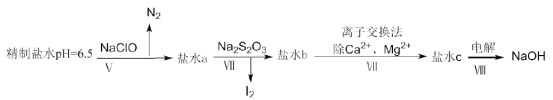
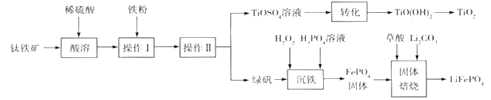
 。
。