-
硫单质及其化合物在化工生成等领域应用广泛。
(1)工业尾气中的SO2一直是环境污染的主要原因之一,工业上常采用如下方法降低尾气中的含硫量:
①方法1:燃煤中加入生石灰,将SO2转化为CaSO3,再氧化为CaSO4
已知:a. CaO(s)+CO2(g) =CaCO3(s) ΔH=-178.3kJ·mol-1
b.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) ΔH=-2762.2kJ·mol-1
c.2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-2314.8kJ·mol-1
写出CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式:____________________________。
②方法2:用氢氧化钠溶液将SO2转化为NaHSO3,再氧化为 Na2SO4。实验测得NaHSO3溶液中 = 1500,则溶液的pH为______________(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
= 1500,则溶液的pH为______________(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
(2)煤制得的化工原料气中含有羰基硫(0=C=S),该物质可转化为H2S,反应为COS(g) +H2(g) H2S (g)+CO(g) ΔH>0。
H2S (g)+CO(g) ΔH>0。
①恒温恒容条件下,密闭容器中发生上述反应,下列事实不能说明反应达到平衡状态的是__________(填字母)。
a.COS的浓度保持不变 b.化学平衡常数不再改变
c.混合气体的密度不再改变 d.形成2molH-S键的同时形成1mol H-H键
②T1℃时,在恒容的密闭容器中,将一定量的CO和H2S混合加热并达到下列平衡:H2S(g)+ CO(g)  COS(g)+H2(g),K=0.25,则该温度下反应COS(g)+H2(g)
COS(g)+H2(g),K=0.25,则该温度下反应COS(g)+H2(g) H2S(g)+ CO(g)的平衡常数K=__________。T1℃时,向容积为10 L的恒容密闭容器中充入1mol COS(g)和1molH2(g),达到平衡时COS的转化率为______________________。
H2S(g)+ CO(g)的平衡常数K=__________。T1℃时,向容积为10 L的恒容密闭容器中充入1mol COS(g)和1molH2(g),达到平衡时COS的转化率为______________________。
(3)过二硫酸(H2S2O8)是一种强氧化性酸,其结构式为
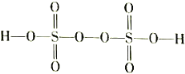 。
。
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,1mol S2O82-能氧化的Mn2+的物质的量为_________mol。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵。则阳极的电极反应式为______________________。
-
硫单质及其化合物在化工生成等领域应用广泛。
(1)工业尾气中的SO2一直是环境污染的主要原因之一,工业上常采用如下方法降低尾气中的含硫量:
①方法1:燃煤中加入生石灰,将SO2转化为CaSO3,再氧化为CaSO4
已知:a. CaO(s)+CO(g)=CaCO3(s) ΔH=-178.3kJ·mol-1
b.2CaCO3(s)+2SO2(g)+O2(g)=2CaSO4(s)+2CO2(g) ΔH=-2762.2kJ·mol-1
c.2CaSO3(s)+O2(g)=2CaSO4(s) ΔH=-2314.8kJ·mol-1
写出CaO(s)与SO2(g)反应生成CaSO3(s)的热化学方程式:_________________。
②方法2:用氨水将SO2转化为NH4HSO3,再氧化为(NH4)2SO4。实验测得NH4HSO3溶液中 = 1500,则溶液的pH为______________(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
= 1500,则溶液的pH为______________(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
(2)煤制得的化工原料气中含有羰基硫(0=C=S),该物质可转化为H2S,反应为COS(g) +H2(g) H2S(g)+CO(g) ΔH>0。
H2S(g)+CO(g) ΔH>0。
①恒温恒容条件下,密闭容器中发生上述反应,下列事实不能说明反应达到平衡状态的是__________(填字母)。
a.COS的浓度保持不变 b.化学平衡常数不再改变
c.混合气体的密度不再改变 d.形成2molH-S键的同时形成1mol H-H键
②T1℃时,在恒容的密闭容器中,将定量的CO和H2S混合加热并达到下列平衡:H2S(g)+ CO(g)  COS(g)+H2(g),K=0 25,则该温度下反应COS(g)+H2(g)
COS(g)+H2(g),K=0 25,则该温度下反应COS(g)+H2(g)  H2S(g)+ CO(g)的平衡常数K=__________。
H2S(g)+ CO(g)的平衡常数K=__________。
③T1℃时,向容积为10 L的恒容密闭容器中充入1mol COS(g)和1molH2(g),达到平衡时COS的转化率为______________________。
(3)过二硫酸(H2S2O8)是一种强氧化性酸,其结构式为 。
。
①在Ag+催化作用下,S2O82-能与Mn2+在水溶液中发生反应生成SO42-和MnO4-,1mol S2O82-能氧化的Mn2+的物质的量为_________mol。
②工业上可用惰性电极电解硫酸和硫酸铵混合溶液制备过二硫酸铵。则阳极的电极反应式为______________________。
-
硫酸是当今世界上最重要的化工产品之一,广泛应用于工业各个方面。硫酸的生产工艺几经改进,目前工业上主要采用接触法制备硫酸。接触室中发生如下反应:2SO2+O2 2SO3。
2SO3。
(1)上述生成SO3的反应属于__________
A.化合反应 B.分解反应
C.置换反应 D.复分解反应
(2)该反应是氧化还原反应,下列说法正确的是__________
A.SO2是氧化剂
B.O2发生氧化反应
C.O2失去电子
D.SO3既是氧化产物又是还原产物
(3)该反应也是放热反应,下列说法不正确的是__________
A.形成SO3中的硫氧键放出能量
B.断开SO2中的硫氧键放出能量
C.反应物的总能量大于生成物的总能量
D.放热反应的逆反应一定是吸热反应
(4)下列关于该反应的说法中,正确的是__________
A.增大接触室内炉气的压强对化学反应速率无影响
B.升高温度能加快反应速率
C.添加催化剂对反应速率无影响
D.增大O2的浓度能使SO2完全转化
-
Na2SO3应用广泛。利用工业废碱渣(主要成分Na2CO3)吸收硫酸厂尾气中的SO2制备无水Na2SO3的成本低,优势明显,其流程如下。
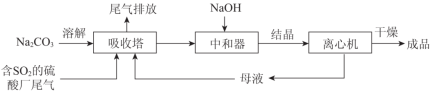
(1)举例说明向大气中排放SO2导致的环境问题:_________。
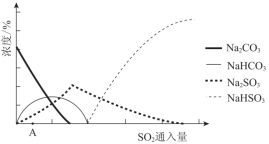
(2)下图为吸收塔中Na2CO3溶液与SO2反应过程中溶液组成变化。则初期反应(图中A点以前)的离子方程式是_________。
(3)中和器中发生的主要反应的化学方程式是_________。
| 资料显示: Ⅰ.Na2SO3在33℃时溶解度最大,将其饱和溶液加热至33℃以上时,由于溶解度降低会析出无水Na2SO3,冷却至33℃以下时析出Na2SO3·7H2O; Ⅱ.无水Na2SO3在空气中不易被氧化,Na2SO3·7H2O在空气中易被氧化。 |
(4)为了降低由中和器所得溶液中Na2SO3的溶解度,从而提高结晶产率,中和器中加入的NaOH是过量的。
①请结合Na2SO3的溶解平衡解释NaOH过量的原因_________。
②结晶时应选择的最佳操作是_________(选填字母)。
A.95~100℃加热蒸发,直至蒸干
B.维持95~100℃蒸发浓缩至有大量晶体析出
C.95 ~100℃加热浓缩,冷却至室温结晶
~100℃加热浓缩,冷却至室温结晶
(5)为检验Na2SO3成品中是否含少量Na2SO4,需选用的试剂是_________、_________。
(6)KIO3滴定法可测定成品中Na2SO3的含量:室温下将0.1260g 成品溶于水并加入淀粉做指示剂,再用酸性KIO3标准溶液(x mol/L)进行滴定至溶液恰好由无色变为蓝色,消耗KIO3标准溶液体积为y mL。
①滴定终点前反应的离子方程式是: IO3-+
IO3-+ SO32- =
SO32- = _______ +
_______ + _______(将方程式补充完整)。
_______(将方程式补充完整)。
②成品中Na2SO3(M = 126 g/mol)的质量分数是_________。
-
从化学角度分析,下列叙述不正确的是


A.利用太阳能蒸馏海水是海水淡化的方法之一
B.研制乙醇汽油技术,可降低机动车辆尾气中有害气体的排放
C.光缆在信息产业中有广泛应用,制造光缆的主要材料是单质硅
D.绿色化学的核心是利用化学原理从源头上减少和消除工农业生产等对环境的污染
-
硫单质和化合物在工农业生产中有着重要的应用,而SO2直接排放会对环境造成危害。
Ⅰ.SO2的尾气处理通常有以下几种方法:
(1)活性炭还原法 反应原理:恒温恒容时2C(s)+2SO2(g) S2(g)+2CO2(g)。反应进行到不同时间测得各物质的浓度部分图象如图:
S2(g)+2CO2(g)。反应进行到不同时间测得各物质的浓度部分图象如图:

①0~20 min反应速率表示为v(SO2)=________;
②30 min时,改变某一条件平衡发生移动,则改变的条件最有可能是________;
③40 min时,平衡常数K=________。
(2)亚硫酸钠吸收法 ①Na2SO3溶液吸收SO2的离子方程式为__________________;
②常温下,当吸收至NaHSO3时,吸收液中相关离子浓度关系一定正确的是___(填序号)。
a.c(Na+)+c(H+)>c( )+c(
)+c( )+c(OH−)
)+c(OH−)
b.水电离出c(H+)=1×10−8 mol/L
c.c(Na+)>c( )>c(H+)>c(
)>c(H+)>c( )
)
(3)电化学处理法
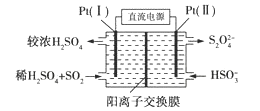
①如图所示,Pt(Ⅰ)电极的反应式为__________________;
②当电路中转移0.02 mol e−时(较浓H2SO4尚未排出),交换膜左侧溶液中约增加____mol离子。
-
沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。
Ⅰ.汽车尾气中的SO2可用石灰水来吸收,生成CaSO3浊液。已知常温下Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9 常温下测得某纯CaSO3与水形成的浊液pH=9,忽略SO32-的第二步水解,则Ksp(CaSO3)=__________ 。CaSO3易变质为CaSO4,水垢中含有较多的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。CaSO4转化为CaCO3的离子方程式为:_________;
Ⅱ.已知25℃时,NH3•H2O电离常数Kb=1.8×10-5,Ksp[Mg(OH)2]=1.0×10-11,向0.4mol/L的氨水中加入等体积浓度为6×10-4mol/L MgCl2 溶液,________沉淀生成(填“无”或“有”),并简述理由______ ;若某溶液中C(Mg2+)=1.2×10-3mol/L,需向其中加入等体积的NaOH溶液浓度为_____ mol/L时,可使Mg2+恰好沉淀完全(忽略溶液体积变化)。
Ⅲ.工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
CrO42- Cr2O72-
Cr2O72- Cr3+
Cr3+ Cr(OH)3
Cr(OH)3
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
①若平衡体系的pH=2,则溶液显____________色。
②能说明第①步反应达平衡状态的是_____________。
A.Cr2O72-和CrO42-的浓度相同 B.2v (Cr2O72-) =v (CrO42-) C.溶液的颜色不变
③第②步中,还原1mol Cr2O72-离子,需要________mol的FeSO4·7H2O。
④第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+ (aq)+3OH-(aq) 常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至__________。
Cr3+ (aq)+3OH-(aq) 常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至__________。
-
沉淀的生成、溶解和转化在无机物制备和提纯以及科研等领域有广泛应用。
Ⅰ.汽车尾气中的SO2可用石灰水来吸收,生成CaSO3浊液。已知常温下Ka1(H2SO3)=1.8×10-2,Ka2(H2SO3)=6.0×10-9 常温下测得某纯CaSO3与水形成的浊液pH=9,忽略SO32-的第二步水解,则Ksp(CaSO3)=__________ 。CaSO3易变质为CaSO4,水垢中含有较多的CaSO4,可先用Na2CO3溶液处理,使之转化为疏松、易溶于酸的CaCO3,而后用酸除去。CaSO4转化为CaCO3的离子方程式为:_________;
Ⅱ.已知25℃时,NH3•H2O电离常数Kb=1.8×10-5,Ksp[Mg(OH)2]=1.0×10-11,向0.4mol/L的氨水中加入等体积浓度为6×10-4mol/L MgCl2 溶液,________沉淀生成(填“无”或“有”),并简述理由______ ;若某溶液中C(Mg2+)=1.2×10-3mol/L,需向其中加入等体积的NaOH溶液浓度为_____ mol/L时,可使Mg2+恰好沉淀完全(忽略溶液体积变化)。
Ⅲ.工业废水中常含有一定量的Cr2O72-和CrO42-,它们会对人类及生态系统产生很大的伤害,必须进行处理。常用的处理方法有还原沉淀法,该法的工艺流程为:
CrO42- Cr2O72-
Cr2O72- Cr3+
Cr3+ Cr(OH)3
Cr(OH)3
其中第①步存在平衡:2CrO42-(黄色)+2H+ Cr2O72-(橙色)+H2O
Cr2O72-(橙色)+H2O
①若平衡体系的pH=2,则溶液显____________色。
②能说明第①步反应达平衡状态的是_____________。
A.Cr2O72-和CrO42-的浓度相同 B.2v (Cr2O72-) =v (CrO42-) C.溶液的颜色不变
③第②步中,还原1mol Cr2O72-离子,需要________mol的FeSO4·7H2O。
④第③步生成的Cr(OH)3在溶液中存在以下沉淀溶解平衡:Cr(OH)3(s) Cr3+ (aq)+3OH-(aq) 常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至__________。
Cr3+ (aq)+3OH-(aq) 常温下,Cr(OH)3的溶度积Ksp=10-32,要使c(Cr3+)降至10-5mol/L,溶液的pH应调至__________。
-
氢氧化钠是一种用途十分广泛的化工原料。工业上主要通过电解氯化钠饱和溶液的方法获得氢氧化钠,我国的氯碱工业大多数采用离子交换膜电解槽。
(1)离子交换膜电解槽一般采用金属钛作阳极,其原因是__________________________________。
阴极一般用碳钢网制成。阳离子交换膜把电解槽隔成阴极室和阳极室,其作用是____________________________________。
(2)为使电解氯化钠的速率加快,下列措施可行的是__________。
a.增大阴极碳钢网的面积
b.提高饱和氯化钠溶液的温度
c.加大阴极与阳极间的距离
d.提高电解时电源电压
(3)如果将某离子交换膜电解槽的①电解时电压增大到原来的2倍;②电解时的电流强度增大到原来的2倍;③电解时温度从30 ℃提高到60 ℃,则电解速率一定会达到原来的2倍的是________________。
-
硫及其化合物有广泛的应用,对SO2性质的研究是高中化学教学的一项重要内容。
I.对比研究是一种重要的研究方法。若将硫的单质及部分化合物按如下表所示分成3 组,则第2组中物质M的化学式是________ 。
| 第1组 | 第2组 | 第3组 |
| S (单质) | SO2、H2SO3、M、NaHSO3 | SO3、H2SO4、Na2SO4、 NaHSO4 |
Ⅱ.某校化学学习小组用下图所示的实验装置研究SO2气体还原Fe3+、Br2的反应。
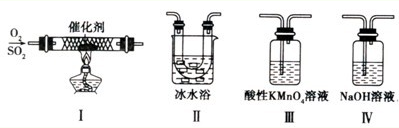
(1)下列实验方案可以用于在实验室制取所需SO2的是 。
A.Na2SO3溶液与HNO3 B.Na2SO3固体浓硫酸
C.固体硫在纯氧中燃烧 D.铜与热的浓硫酸
(2)装置C的作用是除去多余的SO2,防止污染空气。已知在用氢氧化钠溶液吸收SO2的 过程中,往往得到Na2SO3和NaHSO3的混合溶液,常温下,溶液pH随n(SO32—):n(HSO3—)变化关系如下表
| n(SO32—):n(HSO3—) | 91:9 | 1:1 | 9:91 |
| pH | 8.2 | 7.2 | 6.2 |
当吸收液中n(SO32—):n(HSO3—) =10:1时,溶液中离子浓度关系正确的是________ 。
A.c(Na+)+ c(H+)= 2c(SO32—)+ c(HSO3—)+ c(OH—)
B.c(Na+)>c(HSO3—)>c(SO32—)>c(OH—)>c(H+)
C.c(Na+)>c(SO32—)>c(HSO3—)>c(OH—)>c(H+)
(3)在上述装置中通入过量的SO2,为了验证A中SO2与Fe3+发生了氧化还原反应,他们取A中反应后的溶液分成三份,并设计了如下探究实验,请你评价并参与他们的探究过程(限选试剂:KMnO4溶液、KSCN溶液、BaCl2溶液、稀硫酸、稀盐酸、稀硝 酸、Ba(NO3)2溶液、新制的氯水)
| 序号 | 实验方案 | 实验现象 | 结论 |
| 方案① | 往第一份试液中加入KMnO4溶液溶液 | 紫红色褪去 | SO2与Fe3+反应生成了Fe2+ |
| 方案② | 往第二份试液中加入 | | SO2与Fe3+反应生成了Fe2+ |
| 方案③ | 往第二份试液中加入 | | SO2与Fe3+反应生成了SO42— |
上述方案①得出的结论是否合理________,原因 。
如果他们设计的方案②与方案③均合理并且得到相应结论,请你将上面表格补充完整。
(4)装置B中能表明Br—的还原性弱于SO2的现象是________ 。
= 1500,则溶液的pH为______________(已知:H2SO3的Ka1=1.5×10-2,Ka2=1.0×10-7)。
H2S(g)+CO(g) ΔH>0。
COS(g)+H2(g),K=0 25,则该温度下反应COS(g)+H2(g)
H2S(g)+ CO(g)的平衡常数K=__________。
 。
。 。
。



 Cr(OH)3
Cr(OH)3  Cr(OH)3
Cr(OH)3 