-
信使分子NO对人体生命活动有重要意义,在一定温度时可以发生反应2NO+O2
2NO2,如图是在其他条件相同时,分别在有、无催化剂时反应过程的能量变化。下列说法正确的是( )
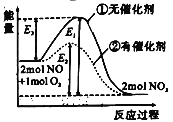
A.该反应为吸热反应
B.逆反应的活化能大于正反应的活化能
C.加入催化剂可以改变反应的焓变
D.该反应的焓变为E1—E2
难度: 中等查看答案及解析
-
已知常温下柠檬水的pH是3,纯碱溶液的pH是11,两溶液中的c(H+)浓度比为( )
A.3:11 B.1:1 C.10—3:10—11 D.10—11:10—13
难度: 简单查看答案及解析
-
根据生活经验,判断下列物质按碱性减弱顺序排列的是( )
A.厨房洗洁净、肥皂、食用白醋、厕所洁厕精、食盐
B.厨房洗洁净、肥皂、食盐、食用白醋、厕所洁厕精
C.厨房洗洁净、肥皂、食用白醋、食盐、厕所洁厕精
D.厕所洁厕精、肥皂、食用白醋、厨房洗洁净、食盐
难度: 简单查看答案及解析
-
目前环境问题已有多种解决方案,垃圾是放错地方的财富,上海实行垃圾分类的措施获得一致好评,某科研小组利用惰性电极和离子交换膜对厨房垃圾发酵液进行直流电渗析法处理可得到乳酸(HA),其原理如图所示(图中HA表示乳酸分子,A—表示乳酸根离子)。下列说法正确的是( )

A.电子从电源a极流到c极,从d极流入电源b极
B.离子交换膜B为阳离子交换膜
C.通电后,左室的pH会上升
D.c电极发生的反应为:2H2O-4e-=4H++O2↑
难度: 中等查看答案及解析
-
可逆反应aA(g)+bB(g)
cC(g)+dD(g)△H,同时符合下图中(a)、(b)各曲线的条件是( )
(a)
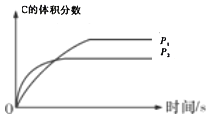 (b)
(b)
A.a+b>c+d P1>P2 △H<0 B.a+b<c+d P1<P2 △H>0
C.a+b<c+d P1>P2 △H<0 D.a+b>c+d P1<P2 △H>0
难度: 中等查看答案及解析
-
25℃时,合成氨的反应热化学方程式为:N2(g)+3H2(g)
2NH3(g) △H=—92.4 kJ/mol,下列有关说法正确的是( )
A.将1 mol N2和3 mol H2置于一定体积的密闭容器中充分反应可放出92.4 kJ的热量
B.选择高温高压条件下能提高合成氨的产量是符合勒夏特列原理指导实际生产的
C.对于合成氨达平衡时减小压强会使正、逆反应速率减小,但平衡逆向移动
D.在一定体积的容器中合成氨时,当容器内的气体密度不再变化说明反应达到化学平衡状态
难度: 中等查看答案及解析
-
有关溶液中下列说法正确的是( )
A.强电解质的导电能力一定比弱电解质强
B.中和等体积等物质的量浓度的盐酸和醋酸,醋酸消耗的氢氧化钠少于盐酸
C.将盐酸和醋酸溶液各稀释一倍,两者的c(H+)均减少到原来的一半
D.NaOH 溶液和氨水pH相等时,其c(OH—)也相等
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.1 L pH=1的H2SO4溶液中含有0.1 NA个H+
B.各取1 L物质的量浓度均为0.1 mol/L的磷酸钠和磷酸溶液,其中都含有0.1 NA个PO43—
C.室温下,0.01 mol/L CH3COONH4,溶液的pH=7,1 L该溶液中含有NH4+数目有0.01 NA
D.将0.01 mol的AlCl3溶于水并加热形成胶体,所得胶粒数最多为0.01 mol Al(OH)3
难度: 中等查看答案及解析
-
稀氨水中存在如下平衡:NH3+H2O
NH3·H2O
NH4+ + OH-,下列向稀氨水中加入下列物质时的描述错误的是( )
A.加入氯化铵固体,平衡逆向移动,溶液pH降低
B.通入更多氨气,平衡正向移动,溶液碱性增强
C.加入氢氧化钠固体,平衡逆向移动,溶液导电性增强
D.加入适量 NaCl溶液,平衡不移动,溶液pH不变
难度: 简单查看答案及解析
-
浓差电池是电化学电池的一种,主要部分包括正、负两个电极与电解质。一般所说的原电池在电池工作时都有某种化学变化发生,因而被称为化学电池;浓差电池虽然也经历了氧化还原过程,但电池的总反应中并没有反映出这种变化,其净作用仅仅是一种物质从高浓度状态向低浓度状态的转移。如图是利用硫酸铜溶液构成的浓差电池的示意图,下列说法错误的是( )

A.电池需采用阳离子交换膜
B.左室发生反应:Cu2++2e—=Cu
C.左室流出硫酸铜溶液物质的量浓度低于2 mol/L
D.工作一段时间后右室电极质量减轻
难度: 中等查看答案及解析
-
下列有关离子方程式正确的是( )
A.碳酸氢钠的水【解析】
HCO3-+H2OH3O++CO32-
B.向明矾溶液中加Ba(OH)2溶液调节pH=12:Al3++SO42-+4OH-+Ba2+═BaSO4↓ +AlO2-+2H2O
C.将锅炉水垢中的硫酸钙用纯碱溶液处理:CaSO4+CO32―=CaCO3+SO42―,
D.Al(OH)3的酸式电离:Al(OH)3=H++AlO2—+H2O
难度: 中等查看答案及解析
-
由下列实验及现象不能推出相应结论的是
选项
实验
现象
结论
A
向两支盛有2 mL相同浓度银氨溶液的试管中滴加2滴相同浓度的NaCl和NaI溶液
一支产生黄色沉淀,另一只无明显现象
Ksp(AgI)<Ksp(AgCl)
B
向10 mL 0.1 mol/L AgNO3溶液中滴加2滴0.01 mol/L NaBr溶液,再滴加2滴0.01 mol/ LNa2S溶液
先产生浅黄色沉淀,然后出现黑色沉淀
Ksp(AgBr)>Ksp(Ag2S)
C
向盛有2 mL 0.1 mol/L MgCl2溶液的试管中先滴加2滴2 mol/L NaOH溶液,再滴加2滴0.01 mol/L CuCl2溶液
先产生白色沉淀,然后白色沉淀变蓝色沉淀
Ksp[Mg(OH)2]>Ksp[Cu(OH)2]
D
将H2S通人浓度均为0.01 mol/L的ZnSO4和CuSO4混合液中
先产生黑色的CuS沉淀
Ksp(ZnS)>Ksp(CuS)
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列有关说法正确的是 ( )
A.电子云通常用小黑点的疏密来表示,小黑点密表示在该空间的电子数多
B.已知Sm的价层电子排布式为4f66s2,Sm3+的价层电子排布式为4f5
C.Cu的核外电子排布为 1s22s22p63s23p63d104s1,所以Cu处于s区
D.原子光谱的特征谱线用于鉴定元素,从1s22s22p33s1跃迁至1s22s22p4时形成是吸收光谱
难度: 简单查看答案及解析
-
下列状态的氯中,电离最外层一个电子所需能量最大的是( )
A.[Ne]3s1 B.[Ne]3s23p5 C.[Ne]3s23p3 D.[Ne]3s2
难度: 简单查看答案及解析
-
下列有关物质结构与性质的说法中合理的是( )
A.CO与CN—结构相似,含有的σ键与π键个数此均为1:2
B.根据VSEPR 理论可知H2O、NH3、CH4分子内键角依次减小
C.铜的电负性为1.9,氯的电负性为3.0,氯化铜为离子化合物,溶于水能完全电离
D.HF比HCl更稳定是因为HF分子间存在氢键
难度: 中等查看答案及解析
-
下列有机反应属于同一反应类型的是( )
A.甲烷与氯气反应制取氯仿、乙烯制取乙醇
B.苯制取溴苯、乙醇与乙酸制取乙酸乙酯
C.乙炔制取1,2—二溴乙烯、乙烯制取环氧乙烷
D.乙醇制取乙醚、乙醛发生银镜反应
难度: 简单查看答案及解析
-
的二氯代物有多种同分异构体,同时满足:①发生银镜反应;②有三种化学环境的氢原子,且个数比为3:2:1的芳香化合物有几种( )
A.2种 B.3种 C.4种 D.6种
难度: 中等查看答案及解析
-
白藜芦醇是肿瘤的化学预防剂,也是对降低血小板聚集,预防和治疗动脉粥样硬化、心脑血管疾病的化学预防剂。花生、葡萄(红葡萄酒)、虎杖、桑椹等植物含有相当多的白蓼芦醇,白藜芦醇是“100种最热门有效抗衰老物质”之一。其结构简式如图,下列有关说法正确的是( )

A.白藜芦醇属于酚类物质,是一种天然的抗氧化剂
B.白藜芦醇极易溶于水,遇Fe3+能发生显色反应,还能被高锰酸钾氧化
C.1 mol 白藜芦醇最多能与 NaOH或H2反应的物质的量为3 mol、6 mol
D.白藜芦醇的所有原子一定不在同一平面
难度: 中等查看答案及解析