-
下列说法正确的是( )
A.将BaSO4放入水中不能导电,所以硫酸钡不是电解质
B.NaCl溶液能导电,所以NaCl溶液是电解质
C.氯化氢溶于水能导电,所以盐酸是电解质
D.固态的NaCl不导电,熔融态NaCl可以导电
难度: 中等查看答案及解析
-
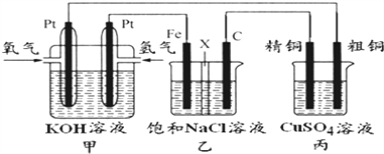
锌–空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,反应为2Zn+O2+4OH–+2H2O===2Zn(OH)42-。下列说法正确的是( )
A.充电时,电解质溶液中K+向阳极移动
B.充电时,电解质溶液中c(OH-) 逐渐减小
C.放电时,负极反应为:Zn+4OH–-2e–= Zn(OH)42-
D.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
难度: 中等查看答案及解析
-
下列各组离子一定能大量共存的是( )
A.在无色溶液中:NH4+、Fe2+、SO42-、CO32-
B.在含大量Ba2+的溶液中:NH4+、Na+、Cl-、OH-
C.在强碱性溶液中:Na+、K+、SO42-、HCO3-
D.在强酸性溶液中:K+、Fe2+、Cl-、SO42-
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增大,X原子的最外层有6个电子,Y是迄今发现的非金属性最强的元素,在周期表中Z位于I A族,W与X属于同一主族。下列说法正确的是
A. 元素X、W的简单阴离子具有相同的电子层结构
B. 由Y、Z两种元素组成的化合物是离子化合物
C. W的简单气态氢化物的热稳定性比Y的强
D. 原子半径:r(X)<r(Y)<r(Z)<r(W)
难度: 中等查看答案及解析
-
反应C(s)+H2O(g)
CO(g)+H2(g)在一可变容积的密闭容器中进行,下列条件的改变对其反应速率几乎无影响的是( )
①增加C的量 ②将容器的体积缩小一半 ③保持体积不变,充入N2使体系压强增大 ④保持压强不变,充入N2使容器体积变大
A.①④ B.②③ C.①③ D.②④
难度: 简单查看答案及解析
-
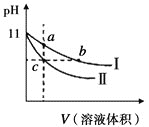
在一定温度下,在体积为2L的恒容密闭容器中,某一反应中X、Y、Z三种气体的物质的量随时间变化的曲线如图所示,下列表述中正确的是
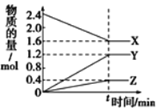
A. 反应的化学方程式为2X=3Y+Z
B. 若t=4,则0~t的X的化学反应速率为0.1mol·L-1·min-1
C. t时,正、逆反应都不再继续进行,反应达到平衡状态
D. 温度、体积不变,t时刻充入1 mol He使压强增大,正、逆反应速率都增大
难度: 中等查看答案及解析
-
下列各组性质比较中,正确的是()
①沸点:
②离子还原性:
③酸性:
④金属性:
⑤气态氢化物稳定性:
⑥半径:
A.①②③ B.③④⑤⑥ C.②③④ D.①③④⑤⑥
难度: 中等查看答案及解析
-
青蒿素是抗疟特效药,属于萜类化合物,如图所示有机物也属于萜类化合物,该有机物的一氯取代物有
不考虑立体异构

A.6种 B.7种 C.8种 D.9种
难度: 困难查看答案及解析
-
ClO2是一种杀菌消毒效率高、二次污染小的水处理剂。实验室中可通过以下反应制得ClO2:
,下列说法不正确的是( )
A.1mol
参加反应,转移2mol电子
B.
在反应中被氧化
C.
的还原性强于ClO2
D.CO2是
被氧化后得到的产物
难度: 中等查看答案及解析
-
100℃时,将0.1molN2O4置于1L密闭的烧瓶中,然后将烧瓶放入100℃的恒温槽中,烧瓶内的气体逐渐变为红棕色:N2O4(g)
2NO2(g)。下列结论不能说明上述反应在该条件下已经达到平衡状态的是( )
①N2O4的消耗速率与NO2的生成速率之比为1:2 ②NO2生成速率与NO2消耗速率相等
③烧瓶内气体的压强不再变化 ④烧瓶内气体的质量不再变化
⑤NO2的物质的量浓度不再改变 ⑥烧瓶内气体的颜色不再加深
⑦烧瓶内气体的平均相对分子质量不再变化 ⑧烧瓶内气体的密度不再变化
A.②③⑥⑦ B.①④⑧ C.只有①④ D.只有⑦⑧
难度: 简单查看答案及解析
-
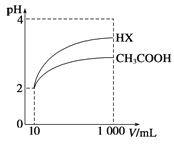
常温下,下列有关电解质溶液的说法中不正确的是( )
A.向0.1mol⋅L-1CH3COOH溶液中加入少量水,溶液中
减小
B.将CH3COONa溶液从20℃升温至30℃,溶液中
减小
C.向盐酸中加入氨水至中性,溶液中
=1
D.向AgCl、AgBr的饱和溶液中加入少量AgNO3,溶液中
不变
难度: 中等查看答案及解析
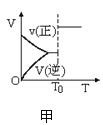 甲:aX(g)+bY(g)
甲:aX(g)+bY(g)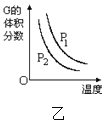 乙:L(s)+aG(g)
乙:L(s)+aG(g)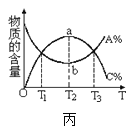 丙:aA+bB
丙:aA+bB 丁:A+2B
丁:A+2B