-
Ⅰ.(化学反应原理)
25℃时,部分物质的电离平衡常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH的电离平衡常数表达式__。
(2)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为__。
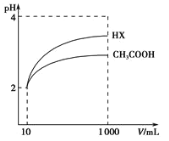
(3)体积均为l00mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数___(填“大于”、“小于”或“等于”)醋酸的电离平衡常数。
Ⅱ.(化学与生活)
防治环境污染,改善生态环境已成为全球共识。
(1)燃煤气化有助于减少PM2.5,写出焦炭与水蒸气反应的化学方程式___。
(2)采用焚烧处理垃圾进行发电已在江苏投入使用。下列是生活中的常见垃圾:
A.废纸 B.废电池 C.易拉罐 D.玻璃瓶 E.塑料制品
在焚烧处理前,除废电池外,还有___(填字母)应剔除并回收,随意丢弃电池造成的主要危害是___。
-
25 ℃时,部分物质的电离平衡常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为___________。
(2)同浓度的CH3COO-、HCO、CO 、ClO-结合H+的能力由强到弱的顺序为_____________。
、ClO-结合H+的能力由强到弱的顺序为_____________。
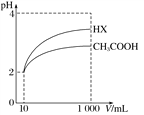
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中pH变化如图所示,则HX的电离平衡常数_____________(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是________________________________。
-
25℃时,部分物质的电离平衡常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)物质的量浓度相等的CH3COONa溶液和NaClO溶液pH大小关系为:c(CH3COONa)_____c(NaClO)(填“>”、“<”或“=”)。
(2)H2CO3的电离方程式为:_____。
(3)向NaClO溶液中通入少量二氧化碳气体,发生反应的离子方程式为:_____。
(4)泡沫灭火器内筒装有Al2(SO4)3溶液,外筒装有NaHCO3溶液。
① Al2(SO4)3溶液呈酸性的原因是:_____。(用离子方程式说明)
② 内、外筒溶液混合后发生反应离子方程式为:_____。
(5)常温下0.1 mol•L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变大的是______。
A.c(H+) B.c(H+)·c(OH-)
C.  D.
D.
(6)H+浓度相等、体积相等的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应后,仅有一份溶液中剩余锌,放出氢气的质量相同,则下列说法正确的是 __(填写序号)。
①开始反应时的速率A>B ②放出等量氢气所需要的时间B>A
③参加反应的锌的物质的量A=B ④A中有锌剩余
-
25℃时,部分物质的电离平衡常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 mol·L-1 | K1=4.4×10-7 mol·L-1 K2=5.6×10-11 mol·L-1- | 3.0×10-8mol·L-1 |
请回答下列问题:
(1)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为________________。
(2)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母序号,下同)。
A.c(H+)
B.
C.c(H+)·c(OH-)
D.
E.
若该溶液升高温度,上述5种表达式的数据增大的是___________。
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:则HX的电离平衡常数__________(填“大于”、“等于”或“小于”)醋酸的平衡常数。稀释后,HX溶液中由水电离出来的c(H+) __________(填“大于”、“等于”或“小于”)醋酸的溶液中由水电离出来的c(H+),理由是______________________________。
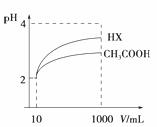
(4)已知100℃时,水的离子积为1×10-12,该温度下测得某溶液pH=7,该溶液显__________(填“酸”、“碱”或“中”)性。将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,则a:b=__________。
-
25℃时,部分物质的电离平衡常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10﹣5mol•L﹣1 | K1=4.4×10﹣7mol•L﹣1 K2=5.6×10﹣11mol•L﹣1 | 3.0×10﹣8mol•L﹣1 |
请回答下列问题:
(1)同浓度的CH3COO﹣、HCO3﹣、CO32﹣、ClO﹣结合H+的能力由强到弱的顺序为________。
(2)常温下0.1mol•L﹣1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母序号,下同)。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)•c(OH﹣) D.c(OH-)/ c(H+) E.c(H+)c(CH3COO-)/ c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是________。
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:
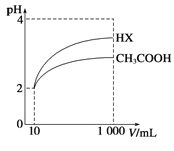
则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数.稀释后,HX溶液中由水电离出来的c(H+)________(填“大于”、“等于”或“小于”)醋酸的溶液中由水电离出来的c(H+),理由是____________________。
(4)已知100℃时,水的离子积为1×10﹣12, 该温度下测得某溶液pH=7,该溶液显________(填“酸”、“碱”或“中”)性.将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,则a∶b=________。
-
25℃时,部分物质的电离平衡常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10﹣5mol•L﹣1 | K1=4.4×10﹣7mol•L﹣1 K2=5.6×10﹣11mol•L﹣1 | 3.0×10﹣8mol•L﹣1 |
请回答下列问题:
(1)同浓度的CH3COO﹣、HCO3﹣、CO32﹣、ClO﹣结合H+的能力由强到弱的顺序为________。
(2)常温下0.1mol•L﹣1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是________(填字母序号,下同)。
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)•c(OH﹣)
D.c(OH-)/c(H+) E.c(H+)c(CH3COO-)/ c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是________。
(3)体积为10mL pH=2的醋酸溶液与一元酸HX溶液分别加水稀释至1000mL,稀释过程pH变化如图:
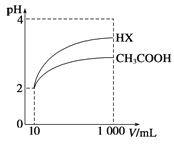
则HX的电离平衡常数________(填“大于”、“等于”或“小于”)醋酸的平衡常数。稀释后,HX溶液中由水电离出来的c(H+)________(填“大于”、“等于”或“小于”)醋酸的溶液中由水电离出来的c(H+),理由是____________________。
(4)已知100℃时,水的离子积为1×10﹣12,该温度下测得某溶液pH=7,该溶液显________(填“酸”、“碱”或“中”)性。将此温度下pH=1的H2SO4溶液aL与pH=11的NaOH溶液bL混合,若所得混合液pH=2,则a∶b=________。
-
25 ℃时,部分物质的电离平衡常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO | H2SO3 |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=1.5×10-2 K2=1.1×10-7 |
请回答下列问题:
(1)写出碳酸的第一级电离平衡常数表达式:K1=_______________________。
(2)CH3COOH、H2CO3、HClO、H2SO3的酸性由强到弱的顺序为____________________。
(3)室温下,向10mL0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是(_______)。
A.溶液中导电粒子的数目减少
B.再加入CH3COONa固体能促进醋酸的电离
C.醋酸的电离程度增大,H+的数目亦増大
D.溶液中 不变
不变
E.再加入10 mL c(OH-)=10-1 mol·L-1的NaOH溶液,醋酸与NaOH恰好中和
(4)物质的量浓度相同的四种溶液CH3COONa b.Na2SO3 c.NaClO d.NaHCO3
pH由小到大排列的顺序是_______________(用编号填写)
(5)物质的量浓度相同的四种溶液a.CH3COONH4,b.NH4HCO3,c.(NH4)2CO3,d.NH4HSO3,C(NH4+)由小到大的顺序是_______________(用编号填写)
(6)写出向NaClO溶液中通入少量CO2的化学方程式____________________________________。
(7)下列化学方程式一定错误的有(_______)
A.2NaHCO3+SO2=Na2SO3+CO2
B.CH3COOH+Na2SO3=CH3COONa+NaHSO3
C.NaClO+SO2+H2O=HClO+NaHSO3
D.CH3COOH+Na2CO3=CH3COONa+NaHCO3
(8)室温下,对于c(ClO-)=0.1 mol·L-1的Ca(ClO)2溶液,下列判断中正确的是(____)。
A. 加水稀释后,溶液中 增大
增大
B. 溶液中c(ClO-)>c(HClO)>c(OH-)>c(H+)
C. 溶液中c(Ca2+)+c(H+)=c(ClO-)+c(OH-)
D. 若溶液的pH=12,则ClO-的水解百分率为10%
-
25 ℃时,部分物质的电离常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为______________________。试写出NaHCO3溶液显碱性的的离子方程式________,
(2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为______________。
(3)体积相同、pH相同的CH3COOH溶液和HClO溶液,与NaOH溶液中和时两者消耗NaOH的物质的量________(填字母)。
A.相同 B.中和CH3COOH的多
C.中和HClO的多 D.无法比较
(4)体积为10 mL pH=2的醋酸溶液与一元酸HX溶液分别加水 稀释至1 000 mL,稀释过程pH变化如图所示,则HX的电离常数 ________(填“大于”“等于”或“小于”)醋酸的电离常数。

(5)H+浓度相同等体积的两份溶液A(盐酸)和B(CH3COOH)分别与锌粉反应,若最后仅有一份溶液中存在锌,放出氢气的质量相同,则下列说法正确的是______ (填写序号)。
①反应所需要的时间B>A ②开始反应时的速率A>B ③参加反应的锌的物质的量A=B
④反应过程的平均速率B>A ⑤A中有锌剩余 ⑥B中有锌剩余
-
25 ℃时,部分物质的电离常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离常数 | 1.7×10-5 | K1=4.3×10-7,K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为______________。
(2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为______。
(3)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___________(填序号),一定不变的是________(填序号)。一定变大的是________(填序号),
A.c(H+) B.c(H+)/c(CH3COOH) C.c(H+)·c(OH-)
D.c(OH-)/c(H+) E. c(CH3COO-)·c(H+)/c(CH3COOH)
若该溶液升高温度,上述5种表达式的数据增大的是____________(填序号)。
-
已知25 ℃时有关弱酸的电离平衡常数如下表:
| 弱酸化学式 | HF | CH3COOH | HClO | H2CO3 |
| 电离常数 | 6.8×10-4 | 1.7×10-5 | 4.7×10-8 | K1=4.3×10-7 K2=5.6×10-11 |
下列推断正确的是
A.弱酸的酸性强弱:HF < HClO
B.同物质的量浓度NaClO与NaHCO3溶液,前者的pH较大
C.将碳酸钠粉末加入到0.1mol·L_1 HClO溶液中,不发生反应
D.中和等体积、等pH的HF和CH3COOH溶液,消耗等量的NaOH





