-
25 ℃时,部分物质的电离平衡常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO | H2SO3 |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=1.5×10-2 K2=1.1×10-7 |
请回答下列问题:
(1)写出碳酸的第一级电离平衡常数表达式:K1=_______________________。
(2)CH3COOH、H2CO3、HClO、H2SO3的酸性由强到弱的顺序为____________________。
(3)室温下,向10mL0.1mol/L醋酸溶液中加水稀释后,下列说法正确的是(_______)。
A.溶液中导电粒子的数目减少
B.再加入CH3COONa固体能促进醋酸的电离
C.醋酸的电离程度增大,H+的数目亦増大
D.溶液中 不变
不变
E.再加入10 mL c(OH-)=10-1 mol·L-1的NaOH溶液,醋酸与NaOH恰好中和
(4)物质的量浓度相同的四种溶液CH3COONa b.Na2SO3 c.NaClO d.NaHCO3
pH由小到大排列的顺序是_______________(用编号填写)
(5)物质的量浓度相同的四种溶液a.CH3COONH4,b.NH4HCO3,c.(NH4)2CO3,d.NH4HSO3,C(NH4+)由小到大的顺序是_______________(用编号填写)
(6)写出向NaClO溶液中通入少量CO2的化学方程式____________________________________。
(7)下列化学方程式一定错误的有(_______)
A.2NaHCO3+SO2=Na2SO3+CO2
B.CH3COOH+Na2SO3=CH3COONa+NaHSO3
C.NaClO+SO2+H2O=HClO+NaHSO3
D.CH3COOH+Na2CO3=CH3COONa+NaHCO3
(8)室温下,对于c(ClO-)=0.1 mol·L-1的Ca(ClO)2溶液,下列判断中正确的是(____)。
A. 加水稀释后,溶液中 增大
增大
B. 溶液中c(ClO-)>c(HClO)>c(OH-)>c(H+)
C. 溶液中c(Ca2+)+c(H+)=c(ClO-)+c(OH-)
D. 若溶液的pH=12,则ClO-的水解百分率为10%
-
25 ℃时,部分物质的电离平衡常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO | NH3·H2O | H2SO3 |
| 电离平衡常数 | 1.8×10-5 | K1=4.2×10-7 K2=5.6×10-11 | 4.7×10-8 | 1.8×10-5 | Ka1=1.3×10−2 Ka2=6.2×10−8 |
(1)25℃时,等浓度的Na2CO3溶液、CH3COONa溶液、Na2SO3溶液,3种溶液的pH由大到小的顺序为____________________________________________。
(2)工业上可用氨水除去尾气SO2。
①若氨水的浓度为2.0mol·L-1,溶液中的c(OH−)=________mol·L−1。向该氨水中加入少量NH4Cl固体,溶液的pH__________(填“升高”或“降低”);若加入少量明矾,溶液中NH 的浓度____________(填“增大”或“减小”)。
的浓度____________(填“增大”或“减小”)。
②将SO2通入氨水中,当c(OH−)降至1.0×10−7mol·L−1时,溶液中的 =_________________。
=_________________。
(3)若某溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
___________c(NH3·H2O)(填“大于”、“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)____________c(OH-)。
(4)根据表中所给的信息,向NaClO溶液中通入少量CO2气体,发生反应的离子方程式为____________________________________________________。
-
25 ℃时,部分物质的电离平衡常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO | NH3·H2O | H2SO3 |
| 电离平衡常数 | 1.8×10-5 | K1=4.2×10-7 K2=5.6×10-11 | 4.7×10-8 | 1.8×10-5 | Ka1=1.3×10−2 Ka2=6.2×10−8 |
(1)25℃时,等浓度的Na2CO3溶液、CH3COONa溶液、Na2SO3溶液,3种溶液的pH由大到小的顺序为____________________________________________。
(2)工业上可用氨水除去尾气SO2。
①若氨水的浓度为2.0 mol·L-1,溶液中的c(OH−)=________mol·L−1。向该氨水中加入少量NH4Cl固体,溶液的pH__________(填“升高”或“降低”);若加入少量明矾,溶液中NH 的浓度____________(填“增大”或“减小”)。
的浓度____________(填“增大”或“减小”)。
②将SO2通入氨水中,当c(OH−)降至1.0×10−7 mol·L−1时,溶液中的c( )/c(
)/c( )=_________________。
)=_________________。
(3)若某溶液是由体积相等的稀盐酸和氨水混合而成,且恰好呈中性,则混合前c(HCl)
___________c(NH3·H2O)(填“大于”、“小于”或“等于”,下同);混合前酸中c(H+)和碱中c(OH-)的关系为c(H+)____________c(OH-)。
(4)根据表中所给的信息,向NaClO溶液中通入少量CO2气体,发生反应的离子方程式为____________________________________________________
-
25℃,电离平衡常数:
| 化学式 | CH3COOH | H2CO3 | HClO | H2SO3 |
| 电离平衡常数 | 1.8×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=1.5×10-2 K2=1.0×10-7 |
回答下列问题:
(1)物质的量浓度为0.1mol/L的下列四种物质:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3;pH由大到小的顺序是_____________(填编号);
(2)在Na2CO3溶液中通入少量的SO2气体,写出离子方程式________________;
(3)用0.1000mol/L NaOH溶液滴定0.1000mol/L 20mL CH3COOH溶液,得到下图曲线在②时,溶液中离子浓度大小顺序为_____________;在①时,测得pH约为5,c(CH3COO-)—c(Na+)=_________mol/L(填精确数值);

(4)常温下,CH3COOH与NH3.H2O的电离平衡常数均为1.8×10-5,则NH4HCO3溶液呈_________性。
-
已知部分弱酸的电离平衡常数如表所示
| 弱酸 | CH3COOH | HClO | H2CO3 | H2SO3 |
| 电离平衡常数Ka(25℃) | 1.75×10-5 | 2.98×10-8 | Ka1=4.30×10-7 Ka2=5.61×10-11 | Ka1=1.54×10-2 Ka2=1.02×10-7 |
下列离子方程式正确的是( )
A.CO2+H2O +2C1O- =CO32-+2HClO B.2CH3COOH+CO32-=2CH3COO-+CO2↑ +H2O
C.SO2+H2O +Ca2+ +2ClO-=CaSO3↓ +2HClO D.SO2+CO32-=CO2+SO32-
-
(10分) 25℃时,电离平衡常数:
| 化学式 | CH3COOH | H2CO3 | HClO | H2C4H4O6(酒石酸) | H2SO3 |
| 电离平衡常数 | 2.0×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 | K1=9.1×10-4 K2=4.3×10-5 | K1=1.3×10-2 K2=6.3×10-8 |
回答下列问题:
(1)pH相同的下列物质的溶液:a.Na2CO3,b.NaClO,c.CH3COONa,d.NaHCO3,e.Na2C4H4O6;物质的量浓度由大到小的顺序是 (填字母)。
(2)常温下,0.1mol/L的CH3COOH溶液的pH== (已知lg2=0.3)。
(3)常温下,将0.1mol/L的次氯酸溶液与0.1mol/L的碳酸钠溶液等体积混合,所得溶液中各种离子浓度关系正确的是
A.c(Na+) > c(ClO-) >c(HCO3-) >c(OH-)
B.c(Na+) > c(HCO3-)>c(ClO-) > c(H+)
C.c(Na+) == c(HClO) +c(ClO-)+ c(HCO3-) + c(H2CO3)+ c(CO32-)
D.c(Na+) + c(H+)== c(ClO-)+ c(HCO3-) + 2c(CO32-)
E.c(HClO) + c(H+)+ c(H2CO3)== c(OH-) + c(CO32-)
(4)写出少量的CO2通入NaClO溶液中的化学方程式 。
(5)0.1mol/L的酒石酸溶液与pH=13的NaOH溶液等体积混合,所得溶液的pH为6,则c(HC4H4O6-)+2 c(C4H4O62-)= 。(用准确的数值表示)
-
Ⅰ.(化学反应原理)
25℃时,部分物质的电离平衡常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH的电离平衡常数表达式__。
(2)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为__。
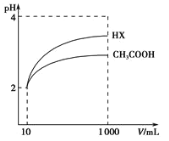
(3)体积均为l00mLpH=2的醋酸溶液与一元酸HX分别加水稀释至1000mL,稀释过程中pH变化如图所示,则HX的电离平衡常数___(填“大于”、“小于”或“等于”)醋酸的电离平衡常数。
Ⅱ.(化学与生活)
防治环境污染,改善生态环境已成为全球共识。
(1)燃煤气化有助于减少PM2.5,写出焦炭与水蒸气反应的化学方程式___。
(2)采用焚烧处理垃圾进行发电已在江苏投入使用。下列是生活中的常见垃圾:
A.废纸 B.废电池 C.易拉罐 D.玻璃瓶 E.塑料制品
在焚烧处理前,除废电池外,还有___(填字母)应剔除并回收,随意丢弃电池造成的主要危害是___。
-
25 ℃时,部分物质的电离平衡常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为__________________。
(2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为____________________。
(3)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___________。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-) D.c(OH-)/c(H+)
E.
若该溶液升高温度,上述5种表达式的数据增大的是___________________。
(4)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程中pH变化如图所示。
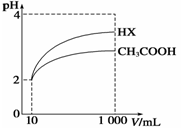
则相同条件下HX的电离平衡常数__________________(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是____________________,稀释后,HX溶液中由水电离出来的c(H+)______________(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+),理由是___________________。
-
25 ℃时,部分物质的电离平衡常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.3×10-7 K2=5.6×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为__________________。
(2)同浓度的CH3COO-、HCO3-、CO32-、ClO-结合H+的能力由强到弱的顺序为____________________。
(3)常温下0.1 mol·L-1的CH3COOH溶液在加水稀释过程中,下列表达式的数据一定变小的是___________。
A.c(H+) B.c(H+)/c(CH3COOH)
C.c(H+)·c(OH-) D.c(OH-)/c(H+)
E.
若该溶液升高温度,上述5种表达式的数据增大的是___________________。
(4)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1 000 mL,稀释过程中pH变化如图所示。

则相同条件下HX的电离平衡常数__________________(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是____________________,稀释后,HX溶液中由水电离出来的c(H+)______________(填“大于”、“等于”或“小于”)醋酸溶液中由水电离出来的c(H+),理由是___________________。
-
25 ℃时,部分物质的电离平衡常数如表所示:
| 化学式 | CH3COOH | H2CO3 | HClO |
| 电离平衡常数 | 1.7×10-5 | K1=4.4×10-7 K2=4.7×10-11 | 3.0×10-8 |
请回答下列问题:
(1)CH3COOH、H2CO3、HClO的酸性由强到弱的顺序为___________。
(2)同浓度的CH3COO-、HCO、CO 、ClO-结合H+的能力由强到弱的顺序为_____________。
、ClO-结合H+的能力由强到弱的顺序为_____________。
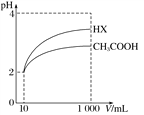
(3)体积为10 mL pH=2的醋酸溶液与一元酸HX分别加水稀释至1000 mL,稀释过程中pH变化如图所示,则HX的电离平衡常数_____________(填“大于”、“等于”或“小于”)醋酸的电离平衡常数;理由是________________________________。
不变
增大




