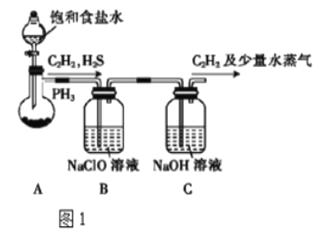
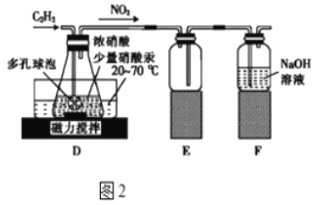
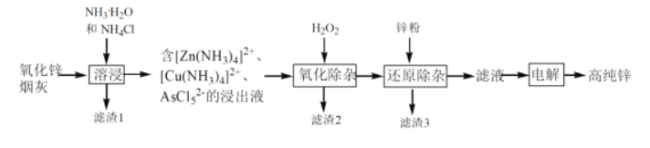
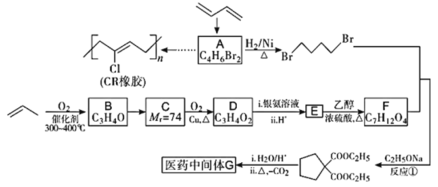
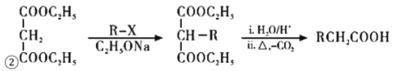-
前20号元素W、X、Y、Z原子序数依次递增,W原子最外层电子数是次外层的3倍,X的简单离子半径在同周期中最小。W、Z的质子数之和等于X、Y的质子数之和,X、Y、Z的最外层电子数之和等于W的核外电子数。下列说法错误的是
A. W与X的简单离子具有相同的电子层结构
B. 1mol Y的最高价氧化物含共价键数目为4NA
C. X、Z分别与W形成的化合物都具有相同类型的化学键
D. X、Y的单质均可以和Z的最高价氧化物对应的水化物溶液反应
难度: 困难查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A. 0.1mol丙烯酸(CH2=CHCOOH)中含有的双键数目为0.1NA
B. 常温常压下,13.8gNO2与足量水反应,转移电子数为0.6NA
C. 7.8gNa2O2和Na2S的固体混合物中含有的离子总数为0.3NA
D. 含NA个CO32-的Na2CO3溶液中,Na+数目为2NA
难度: 中等查看答案及解析
-
化学无处不在,下列说法错误的是( )
A. 《元丰行示德逢》里“雷蟠电掣云滔滔,夜半载雨输亭皋”涉及化学反应N2+O2
2NO
B. 根据化学学科核心素养之一(证据推理与模型认知)可推知Cr(OH)3胶体也可吸附悬浮杂质
C. 纳米铁粉可以高效地去除污水中的重金属离子是因为其具有较强的还原性
D. 二氧化硅广泛用于制作光导纤维,光导纤维遇强酸强碱都会“断路”
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A.Ca(CH3COO)2溶液与硫酸反应:Ca2++SO42-═CaSO4↓
B.Fe(OH)3溶于HI溶液:Fe(OH)3+3H+═Fe3++3H2O
C.(NH4)2SO4溶液中加入Ba(OH)2溶液:NH4++SO42-+Ba2++OH-═BaSO4↓+NH3•H2O
D.向NaAlO2溶液滴入NaHCO3溶液产生白色沉淀:AlO2-+HCO3-+H2O═Al(OH)3↓+CO32-
难度: 中等查看答案及解析
-
下列物质能实现“
 ”转化关系的是
”转化关系的是A. Al B. FeO C. NaHCO3 D. NH3
难度: 中等查看答案及解析
-
常温下,将一定量的氨基甲酸铵置于密闭真空容器中(固体体积忽略不计)发生反应:H2NCOONH4(s)
2NH3(g)+CO2(g)△H,达到平衡时测得c(CO2)=amol·L-1。温度不变,达到平衡后压缩容器体积至原来的一半,达到新平衡时测得c(NH3)=xmol·L-1。下列说法正确的是( )
A. 混合气体的平均相对分子质量不再变化时表明达到平衡状态
B. 达到新平衡时,△H为原来的2倍
C. 上述反应达到新平衡状态时x=2a
D. 上述反应体系中,压缩容器体积过程中n(H2NCOONH4)不变
难度: 困难查看答案及解析
-
原电池与电解池在生活和生产中有着广泛应用。下列有关判断中错误的是( )
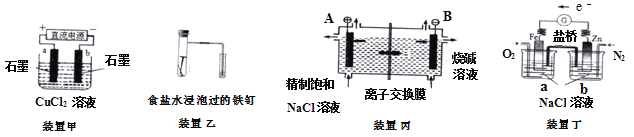
A. 装置甲研究的是电解CuCl2溶液,它将电能转化为化学能
B. 装置乙研究的是金属的吸氧腐蚀,Fe上的反应为Fe - 2e -- = Fe2+
C. 装置丙研究的是电解饱和食盐水,B电极发生的反应:2Cl- -2e-- = Cl2↑
D. 向装置丁烧杯a中加入少量K3[Fe(CN)6]溶液,没有蓝色沉淀生成
难度: 中等查看答案及解析
-
下列关于有机物的说法正确的是( )
A.葡萄糖与果糖、淀粉与纤维素均互为同分异构体
B.2,2-二甲基丙烷可以由烯烃通过加成反应制得
C.分子式为C5H12O的有机物,能与Na反应放出氢气的结构有8种
D.汽油、柴油、植物油都是碳氢化合物
难度: 中等查看答案及解析
-
下列各组物质相互混合反应后,最终有白色沉淀生成的是
①金属钠投入到FeCl3溶液中 ②过量NaOH溶液和明矾溶液混合 ③少量Ca(OH)2投入过量NaHCO3溶液中 ④向NaAlO2溶液中滴入NaHCO3溶液 ⑤向饱和Na2CO3溶液中通入足量CO2 ⑥氯化钙溶液中通入少量的CO2
A.①③④⑤ B.只有①④ C.只有②③⑥ D.只有③④⑤
难度: 中等查看答案及解析
-
已知:还原性HSO3->I-,氧化性IO3->I2。在含3mol NaHSO3的溶液中逐滴加人KIO3溶液。加入KIO3和析出I2的物质的量的关系曲线如图所示。下列说法不正确的是
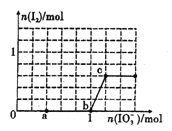
A. 0-a段发生反应:3HSO3-+IO3-=3SO42-+I-+3H+
B. a~b段共消耗NaHSO3的物质的量为1.8mol
C. b~c段反应:氧化产物为I2
D. 当溶液中I-与I2的物质的量之比为5 : 1时,加入的KIO3为1.lmol
难度: 困难查看答案及解析
-
下列图示与对应的叙述相符的是
A.
如图表示同温度下,
的盐酸和醋酸溶液分别加水稀释时pH的变化曲线,其中曲线Ⅱ为盐酸,且b点溶液的导电性比a点强
B.
如图表示
溶液滴定
溶液所得到的滴定曲线
C.
如图表示压强对可逆反应
的影响,乙的压强比甲的压强大
D.
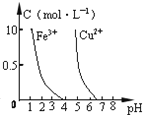 如图若除去
如图若除去溶液中的
可向溶液中加入适量CuO至pH在4左右
难度: 中等查看答案及解析
-
目前研究比较热门的Al-H2O2电池,其电池总反应为2Al+3HO2-= 2AlO2-+OH-+H2O。现以Al-H2O2电池电解尿素[CO(NH2)2]的碱性溶液制备氢气(装置2中隔膜仅阻止气体通过,b、c、d均为惰性电极)。下列说法错误的是

A. 左装置 中Na+移向电极b
B. 电极c的电极反应式:CO(NH2)2-6e-+6OH-= CO2↑+N2↑+5H2O
C. 电解时,电子流动路径:Al极→导线→d极,c极→导线→b极
D. 通电2 min后,Al电极的质量减轻2.7 g,则产生H2的体积为3.36 L(标准状况)
难度: 中等查看答案及解析
-
下列有关实验的图示及分析均正确的是( )
选项
实验目的
实验图示
实验分析
A
实验室用酸性高锰酸钾溶液滴定草酸溶液

摇瓶时,使溶液向一个方向做圆运动,勿使瓶口接触到滴定管,溶液也不得溅出
B
石油分馏时接收馏出物

为收集到不同沸点范围的馏出物,需要不断更换锥形瓶
C
测定锌与稀硫酸反应生成氢气的速率
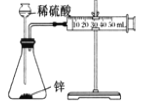
实验中需测定的物理量是反应时间和生成氢气的体积
D
用四氯化碳萃取碘水中的碘
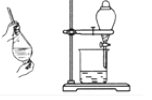
充分震荡后静置,待溶液分层后,先把上层液体从上口倒出,再让下层液体从下口流出
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
常温下,用0.100mol/L 的AgNO3溶液滴定50.0mL,0.0500mol/L KCl溶液,以K2CrO4为指示剂,测得溶液中pCl=-lgc(Cl-) 、pAg=-lgc(Ag+)随加入AgNO3的体积变化如图所示,已知溶液中离子浓度小于等于1.0×10-5mol/L则沉淀完全,Ksp(Ag2CrO4)=2.0×10-12,Ksp(Ag2SO4)=1.4×10-5,下列说法错误的是( )
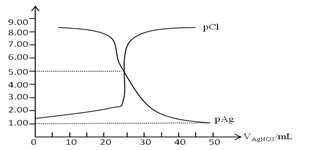
A.AgCl的沉淀溶解平衡常数Ksp数量级为10-10
B.为防止指示剂失效,溶液应维持中性或弱碱性
C.滴定中指示剂的有效浓度应维持在2.0×10-2 mol/L
D.滴定完后加入1mL 0.01mol/L H2SO4会产生新的沉淀
难度: 困难查看答案及解析
-
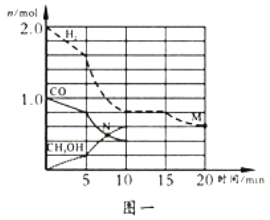
在容积为2L的刚性密闭容器中,加入1mol CO2和3mol H2,发生反应CO2+3H2⇌CH3OH+H2O。在其他条件不变的情况下,温度对反应的影响结果如图所示(注:T1、T2均大于300℃)。下列说法正确的是
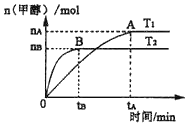
A. 该反应在T1时的平衡常数比T2时的小
B. 处于A点的反应体系从T1变到T2,达到平衡时
减小
C. T2下,反应达到平衡时生成甲醇的平均速率为v(CH3OH)=
mol•L﹣1•min﹣1
D. T1下,若反应达到平衡后CO2转化率为a,则容器内的压强与起始压强之比为(2﹣a):2
难度: 中等查看答案及解析
-
已知NaCN溶液中CN-水解常数
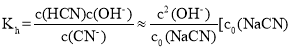 是NaCN溶液的起始浓度]。25℃时,向c0的NaCN溶液中不断加水稀释,NaCN溶液浓度的对数值lgc0与2pOH[pOH-=-lg c(OH-)]的关系如图。
是NaCN溶液的起始浓度]。25℃时,向c0的NaCN溶液中不断加水稀释,NaCN溶液浓度的对数值lgc0与2pOH[pOH-=-lg c(OH-)]的关系如图。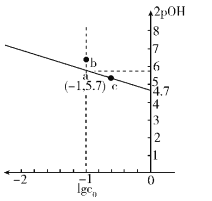
下列说法不正确的是
A. 其它条件不变,降低温度,可使b点变到a点
B. 相同温度时,c点对应溶液中的pH大于a点
C. 由图可知,25 ℃时,Kh(CN-)≈10-4.7
D. 向1 L lgc0=0的NaCN溶液中通入0.5 mol HCl气体,所得溶液中c(CN-)<c(HCN)
难度: 困难查看答案及解析
-
X、Y、Z、W 为原子序数依次增大的四种短周期元素,其中Z为金属元素,X、W为同一主族元素。X、Z、W形成的最高价氧化物分别为甲、乙、丙。x、y2、z、w分别为X、Y、Z、W的单质,丁是化合物。其转化关系如图所示,下列判断错误的是

A.反应①、②、③都属于氧化还原反应
B.X、Y、Z、W四种元素中,Y的原子半径最小
C.Na 着火时,可用甲扑灭
D.一定条件下,x与甲反应生成丁
难度: 中等查看答案及解析
-
有机物的结构可用“键线式”表示,如CH3—CH=CH—CH3可简写为
,有机物X的键线式为
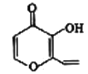 。下列关于有机物X的说法中正确的是
。下列关于有机物X的说法中正确的是A.X的分子式为C7H8O3
B.X与乙酸乙酯含有相同的官能团
C.X因能与酸性KMnO4溶液发生加成反应而褪色
D.有机物Y是X的同分异构体,能与碳酸氢钠溶液反应且含有苯环,则Y的结构有3种
难度: 中等查看答案及解析
-
某溶液中可能含有下列6种离子中的某几种:Cl-、SO42-、CO32-、NH4+、Na+、K+。为确认溶液组成进行如下实验:(1) 200 mL上述溶液,加入足量BaCl2溶液,反应后将沉淀过滤、洗涤、干燥,得沉淀4.30 g,向沉淀中加入过量的盐酸,有2.33 g沉淀不溶。(2) 向(1)的滤液中加入足量的NaOH溶液,加热,标准状况下产生能使湿润红色石蕊试纸变蓝的气体1.12 L。由此可以得出关于原溶液组成的正确结论是
A. 一定存在SO42-、CO32-、NH4+,可能存在Cl-、Na+、K+
B. 一定存在SO42-、CO32-、NH4+、Cl-,一定不存在Na+、K+
C. c(CO32-)=0.01mol·L-1,c(NH4+)>c(SO42-)
D. 如果上述6种离子都存在,则c(Cl-)>c(SO42-)
难度: 困难查看答案及解析
-
绿水青山是习近平总书记构建美丽中国的伟大构想,某工厂拟综合处理含NH4+废水和工业废气(主要含N2、CO2、SO2、NO、CO,不考虑其他成分),设计了如下流程:
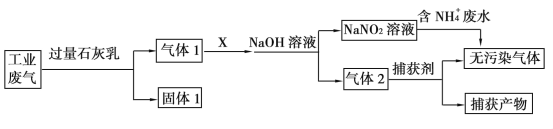
已知:NO+NO2+2OH-=2NO2-+H2O
下列说法正确的是
A.固体1中主要含有CaCO3、CaSO4
B.X可以是空气,且需过量
C.处理含NH4+废水时,发生的反应为:NH4++5NO2-+4H+=6NO
+4H2O
D.捕获剂所捕获的气体主要是CO
难度: 中等查看答案及解析