-
工业上可通过煤的液化合成甲醇,主反应为:
CO(g)+2H2(g) CH3OH(l) △H=x。
CH3OH(l) △H=x。
(1)已知常温下CH3OH、H2和CO 的燃烧热分别为726.5 kJ/mol、285.5 kJ/mol、283.0 k J/mol,则x=____;为提高合成甲醇反应的选择性,关键因素是__________________________。
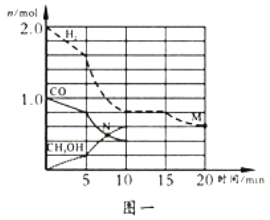
(2)TK下,在容积为1.00 L的某密闭容器中进行上述反应,相关数据如图一。
①该化学反应0~10 min的平均速率v(H2)=_______;M和N点的逆反应速率较大的是_____(填“v逆(M)”、“v逆(N)”或“不能确定”)。
②10 min时容器内CO的体积分数为______。

③对于气相反应,常用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)表示平衡常数(以KP表示),其中,pB=p总×B的体积分数;若在TK 下平衡气体总压强为x atm,则该反应KP=____(计算表达式)。实验测得不同温度下的lnK(化学平衡常数K 的自然对数)如图二,请分析1nK 随T呈现上述变化趋势的原因是________________。
(3)干燥的甲醇可用于制造燃料电池。
①研究人员发现利用NaOH 干燥甲醇时,温度控制不当会有甲酸盐和H2生成,其反应方程式为______________________________;
②某高校提出用CH3OH-O2燃料电池作电源电解处理水泥厂产生的CO2(以熔融碳酸盐为介质),产物为C 和O2。其阳极电极反应式为___________________________。
-
工业上可通过煤的液化合成甲醇,主反应为:
CO(g)+2H2(g) CH3OH(l) △H=x。
CH3OH(l) △H=x。
(1)已知常温下CH3OH、H2和CO 的燃烧热分别为726.5 kJ/mol、285.5 kJ/mol、283.0 k J/mol,则x=____;为提高合成甲醇反应的选择性,关键因素是__________________________。
(2)TK下,在容积为1.00 L的某密闭容器中进行上述反应,相关数据如图一。
①该化学反应0~10 min的平均速率v(H2)=_______;M和N点的逆反应速率较大的是_____(填“v逆(M)”、“v逆(N)”或“不能确定”)。
②10 min时容器内CO的体积分数为______。

③对于气相反应,常用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)表示平衡常数(以KP表示),其中,pB=p总×B的体积分数;若在TK 下平衡气体总压强为x atm,则该反应KP=____(计算表达式)。实验测得不同温度下的lnK(化学平衡常数K 的自然对数)如图二,请分析1nK 随T呈现上述变化趋势的原因是________________。
(3)干燥的甲醇可用于制造燃料电池。
①研究人员发现利用NaOH 干燥甲醇时,温度控制不当会有甲酸盐和H2生成,其反应方程式为______________________________;
②某高校提出用CH3OH-O2燃料电池作电源电解处理水泥厂产生的CO2(以熔融碳酸盐为介质),产物为C 和O2。其阳极电极反应式为___________________________。
-
工业上可通过煤的液化合成甲醇,主反应为:CO(g)+2H2(g) CH3OH(l) △H=x。
CH3OH(l) △H=x。
(1)已知常温下CH3OH、H2和CO 的燃烧热分别为726.5kJ/mol、285.5 kJ/mol、283.0kJ/mol,则x=__。
(2)TK下,在容积为1.00L的某密闭容器中进行上述反应相关数据如图一。
①该化学反应0-10min的平均速率v(H2)=___。
②10min时容器内CO的体积分数为___。
③对于气相反应,常用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)表示平衡常数(以KP表示),其中,pB=p总×B的体积分数;若在TK下三种气体的平衡气体总压强为xMPa,则该反应Kp=__(计算表达式表示)。实验测得不同温度下的lnK(化学平衡常数K的自然对数)如图二,请分析lnK随T呈现上述变化趋势的原因是__。

(3)干燥的甲醇可用于制造燃料电池。
某高校提出用CH3OH-O2燃料电池作电源电解处理水泥厂产生的CO2(以熔融碳酸盐为介质),产物为C和O2。其阳极电极反应式为__。
-
工业上可通过煤的液化合成甲醇,主反应为:
CO(g)+2H2(g)  CH3OH(1) △H=xkJ/mol
CH3OH(1) △H=xkJ/mol
(1)己知常温下CH3OH(1)、H2和CO的燃烧热分別为726.5kJ/mol、285.5kJ/mol、283.0kJ/mol,则x=___________;为提高合成甲醇反应的选择性,关键因素是___________。
(2)TK下,在容积为1.00L的某密闭容器中进行反应CO(g)+2H2(g)  CH3OH(g) △H<0,相关数据如图。
CH3OH(g) △H<0,相关数据如图。
①该反应0~10min的平均速率υ(H2)___________mol/(L·min);M和N点的逆反应速率较大的是___________(填“υ逆(M)”、“υ逆(N)”或“不能确定”)。
②10min时容器内CO的体积分数为___________。

③对于气相反应,常用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)表示平衡常数(以Kp表示),其中PB=P总×B的体积分数。若在TK下平衡气体总压强为xMPa,则该反应的平衡常数Kp=___________(写出表达式,不必化简)。实验测得不同温度下的lnKp(化学平衡常数Kp的自然对数)如图,请分析lnKp随T呈现上述变化趋势的原因______________________。
-
工业上可通过煤的液化合成甲醇,主反应为:CO(g)+2H2(g)=CH3OH(l) △H=x
(1)己知常温下CH3OH、H2和CO的燃烧热分別为726.5kl/mo1、285.5kJ/mol、283.0kJ/mol,則x=_______;为提高合成甲醇反应的选择性,关键因素是___________。
(2)TK下,在容积为1.00 L的某密闭容器中进行上述反应(CH3OH为气体),相关数据如图。

①该反应0-10min的平均速率v(H2)=_______;M和N点的逆反应速率较大的是______(填“v逆(M)”、“v逆(N)”或“不能确定”) 。
②10min时容器内CO的体积分数为_______。相同条件下,若起始投料加倍,达平衡时,CO的体积分数将________(填“增大”、“减小”或“不变”)
③对于气相反应,常用某组分(B)的平衡压强(PB)代替物质的量浓度(CB)表示平衡常数(以Kp表示),其中,PB=P总×B的体积分数;若在TK下平衡气体总压强xatm,则该反应Kp=____(计算表达式)。实验测得不同温度下的lnK(化学平衡常数K的自然对数)如图,请分析lnK随T呈现上述变化趋势的原因是:____________。

-
甲醇是重要的化工原料。在催化剂的作用下,利用合成气(主要成分为CO、CO2和H2)合成甲醇的主要化学反应如下:
Ⅰ.CO(g)+2H2(g) CH3OH(g) ΔH1
CH3OH(g) ΔH1
Ⅱ.CO2(g)+3H2(g) CH3OH(g)+H2O(g) ΔH2=−58 kJ·mol−1
CH3OH(g)+H2O(g) ΔH2=−58 kJ·mol−1
Ⅲ.CO2(g)+H2(g) CO(g)+H2O(g) ΔH3
CO(g)+H2O(g) ΔH3
请回答下列问题:
(1)化学反应热ΔH=生成物标准生成热总和−反应物标准生成热总和。已知四种物质的标准生成热如下表:
| 物质 | CO(g) | CO2(g) | H2(g) | CH3OH(g) |
| 标准生成热(kJ·mol−1) | −110.52 | −393.51 | 0 | −201.25 |
①计算ΔH1=________ kJ·mol−1 。
②ΔH3________ 0 (填“=”“>”或“<”)。
(2)当合成气的组成比n(H2) /n(CO+CO2)=2.60时,体系中CO的平衡转化率(α)与温度和压强的关系如图所示:
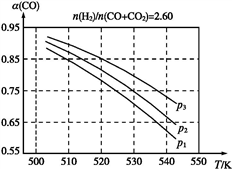
①α(CO)随温度升高而________(填“增大”或“减小”)。
②图中p1、p2、p3的大小关系为________,判断的理由是___________________________________________________________________________。
(3)在一定条件下由甲醇可以制备甲醚。一定温度下,在三个体积均为1 L的恒容密闭容器中发生反应:2CH3OH(g) CH3OCH3(g)+H2O(g),实验数据见下表:
CH3OCH3(g)+H2O(g),实验数据见下表:
| 编号 | 温度/℃ | 起始物质的量/mol | 平衡物质的量/mol |
| CH3OH(g) | CH3OCH3(g) | H2O(g) | CH3OCH3(g) | H2O(g) |
| a | 387 | 0.2 | 0 | 0 | 0.08 | 0.08 |
| b | 387 | 0.4 | 0 | 0 | | |
| c | 207 | 0.2 | 0 | 0 | 0.09 | 0.09 |
| | | | | | |
下列说法正确的是________。
A.该反应的正反应是放热反应
B.平衡时容器a中CH3OH的体积分数比容器b中的小
C.若a是容积为1 L的绝热容器,则平衡时a中CH3OH的转化率增大
D.若起始时向容器a中充入0.15molCH3OH(g)、0.15molCH3OCH3(g)和0.1molH2O(g),则反应向正反应方向进行
(4)直接甲醇燃料电池(Direct Methanol Fuel Cell,DMFC)属于质子交换膜燃料电池,其工作原理如图所示:
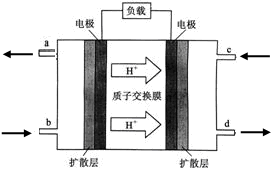
①c处通入的气体是________。
②负极的电极反应式是__________________________________________。
-
甲醇是一种可再生能源,具有广泛的开发和应用前景。
(1)工业上一般采用两种方法制备甲醇:
反应Ⅰ:CO(g) + 2H2 (g)  CH3OH (g) DH1
CH3OH (g) DH1
反应Ⅱ:CO2(g) + 3H2(g)  CH3OH (g)+H2O(g) DH2
CH3OH (g)+H2O(g) DH2
① 下表所列数据是反应Ⅰ在不同温度下的化学平衡常数(K)。
| 温度 | 250℃ | 300℃ | 350℃ |
| K | 2.041 | 0.270 | 0.012 |
由表中数据判断DH1_______________0(填“<”、“=”或“>”)。
② 某温度下,将2molCO和6molH2充入2L密闭容器中充分反应,4分钟后反应达到平衡,测得CO的物质的量为0.4mol,则CO的反应速率为________________,此时的压强是反应前压强的___________倍。
(2)反应Ⅱ的平衡常数表达式为____________________,为了加快反应Ⅱ的反应速率,并且提高H2的转化率,采取的措施是_______________(填写正确选项的字母)。
a.增大CO2的浓度 b.增大H2的浓度
c.增大压强 d.加入催化剂
(3)工业上利用CO与水蒸气的反应,将有毒的CO转化为无毒的CO2,书写有关热化学反应方程式__________________________________。该反应在830K下进行时,初始浓度到达平衡的时间有如下的关系:
| CO的初始浓度(mol/L) | 2 | 4 | 1 | 3 |
| H2的初始浓度(mol/L) | 3 | 2 | 3 | 3 |
| 时间(min) | 8 | 6 | 12 | n |
则n 为________min。
(4)近年来,科研人员新开发出一种甲醇和氧气以强碱溶液为电解质溶液的新型手机电池。该电池中甲醇发生反应的一极为______极、其电极反应式为_________________。
(5)用该电池作电源,用惰性电极电解饱和NaCl溶液时,每消耗0.2mol CH3OH,阴极产生标况下气体的体积为________L。
-
利用合成气 (主要成分为 CO、CO2和 H2)在催化剂的作用下合成甲醇,发生的主反应如下:
(主要成分为 CO、CO2和 H2)在催化剂的作用下合成甲醇,发生的主反应如下:
①CO(g)+2H2(g) CH3OH(g) △H1=-99kJ·mol-1
CH3OH(g) △H1=-99kJ·mol-1
②CO2(g)+3H2(g) CH3OH(g)+H2O(g) △H2
CH3OH(g)+H2O(g) △H2
③CO2(g)+H2(g) CO(g)+H2O(g) △H3=+41kJ·mol-1
CO(g)+H2O(g) △H3=+41kJ·mol-1
已知反应①中的相关的化学键键能数据如下,则 C-H 键能和△H2分别是

A.403 kJ·mol-1,-66 kJ·mol-1 B.423 kJ·mol-1,+28 kJ·mol-1
C.413 kJ·mol-1,-58 kJ·mol-1 D.314 kJ·mol-1,-18 kJ·mol-1
-
甲醇可作为燃料电池的原料。CO2和CO可作为工业合成甲醇(CH3OH)的直接碳源,
(1)已知在常温常压下:
①CH3OH(l)+ O2(g)=CO(g) + 2H2O(g); ΔH=﹣355.0 kJ∕mol
②2CO(g)+ O2(g)= 2CO2(g) ΔH=-566.0 kJ/mol
③H2O(l)=H2O(g) ΔH=+44.0 kJ/mol
写出表示甲醇燃烧热的热化学方程式:___________________________
(2)利用CO和H2在一定条件下可合成甲醇,发生如下反应:CO(g)+2H2(g)=CH3OH(g),其两种反应过程中能量的变化曲线如下图a、b所示,下列说法正确的是__________
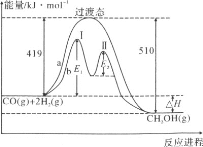
A.上述反应的ΔH=-91kJ·mol-1
B.a反应正反应的活化能为510kJ·mol-1
C.b过程中第Ⅰ阶段为吸热反应,第Ⅱ阶段为放热反应
D.b过程使用催化剂后降低了反应的活化能和ΔH
E.b过程的反应速率:第Ⅱ阶段>第Ⅰ阶段
(3)下列是科研小组设计的一个甲醇燃料电池,两边的阴影部分为a,b惰性电极,分别用导线与烧杯的m,n相连接,工作原理示意图如图:
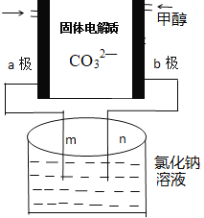
①b极电极反应式为____________。
②在标准状况下,若通入112mL的O2,(假设烧杯中的溶液的体积为200mL,体积不变)最后反应终止时烧杯中溶液的pH为______。
(4)可利用CO2根据电化学原理制备塑料,既减少工业生产对乙烯的依赖,又达到减少CO2排放的目的。以纳米二氧化钛膜为工作电极,稀硫酸为电解质溶液,在一定条件下通入CO2进行电解,在阴极可制得低密度聚乙烯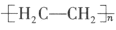 (简称LDPE)。
(简称LDPE)。
①电解时,阴极的电极反应式是________。
②工业上生产1.4×102kg的LDPE,理论上需要标准状况下________L的CO2。
-
硼酸三甲酯用作柠檬类水果的熏蒸剂。实验室合成硼酸三甲酯的原理及装置如下:Na2B4O7•10H2O+2H2SO4+12CH3OH 2NaHSO4+4(CH3O)3B+17H2O
2NaHSO4+4(CH3O)3B+17H2O

已知:
| 硼酸三甲酯 | 甲醇 |
| 溶解性 | 与乙醚、甲醇混溶,能水解 | 与水混溶 |
| 沸点/℃ | 68 | 64 |
| 硼酸三甲酯与甲醇混合物的共沸点为54℃ |
实验步骤如下:
①在圆底烧瓶中加入44.8g甲醇和191.gNa2B4O7•10H2O(硼砂,式量为382),然后缓慢加入浓H2SO4并振荡;加热烧瓶中的液体;通过分馏柱回流一段时间。
②先接收51~55℃的馏分,再接收55~60℃的馏分。
③将两次馏分合并,加入氯化钙进行盐析分层,上层为硼酸三甲酯,分离。
④精馏得高纯硼酸三甲酯19.2g。
回答下列问题:
(1)图中仪器a的名称为__;直形冷凝管冷却水应从__(填“b”或“c”)接口进入。
(2)本实验加热方式为__,优点是__。
(3)加入氯化钙盐析分层的主要目的是__。
(4)U型管中P2O3的作用是__。
(5)图中,步骤④的仪器选择及安装都正确的是__,应收集__℃的馏分。

(6)本次实验的产率是__。
CH3OH(l) △H=x。












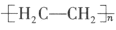 (简称LDPE)。
(简称LDPE)。
