-
工业上可通过煤的液化合成甲醇,主反应为:
CO(g)+2H2(g)  CH3OH(1) △H=xkJ/mol
CH3OH(1) △H=xkJ/mol
(1)己知常温下CH3OH(1)、H2和CO的燃烧热分別为726.5kJ/mol、285.5kJ/mol、283.0kJ/mol,则x=___________;为提高合成甲醇反应的选择性,关键因素是___________。
(2)TK下,在容积为1.00L的某密闭容器中进行反应CO(g)+2H2(g)  CH3OH(g) △H<0,相关数据如图。
CH3OH(g) △H<0,相关数据如图。
①该反应0~10min的平均速率υ(H2)___________mol/(L·min);M和N点的逆反应速率较大的是___________(填“υ逆(M)”、“υ逆(N)”或“不能确定”)。
②10min时容器内CO的体积分数为___________。

③对于气相反应,常用某组分(B)的平衡压强(PB)代替物质的量浓度(cB)表示平衡常数(以Kp表示),其中PB=P总×B的体积分数。若在TK下平衡气体总压强为xMPa,则该反应的平衡常数Kp=___________(写出表达式,不必化简)。实验测得不同温度下的lnKp(化学平衡常数Kp的自然对数)如图,请分析lnKp随T呈现上述变化趋势的原因______________________。
-
工业上可通过煤的液化合成甲醇,主反应为:
CO(g)+2H2(g) CH3OH(l) △H=x。
CH3OH(l) △H=x。
(1)已知常温下CH3OH、H2和CO 的燃烧热分别为726.5 kJ/mol、285.5 kJ/mol、283.0 k J/mol,则x=____;为提高合成甲醇反应的选择性,关键因素是__________________________。
(2)TK下,在容积为1.00 L的某密闭容器中进行上述反应,相关数据如图一。
①该化学反应0~10 min的平均速率v(H2)=_______;M和N点的逆反应速率较大的是_____(填“v逆(M)”、“v逆(N)”或“不能确定”)。
②10 min时容器内CO的体积分数为______。

③对于气相反应,常用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)表示平衡常数(以KP表示),其中,pB=p总×B的体积分数;若在TK 下平衡气体总压强为x atm,则该反应KP=____(计算表达式)。实验测得不同温度下的lnK(化学平衡常数K 的自然对数)如图二,请分析1nK 随T呈现上述变化趋势的原因是________________。
(3)干燥的甲醇可用于制造燃料电池。
①研究人员发现利用NaOH 干燥甲醇时,温度控制不当会有甲酸盐和H2生成,其反应方程式为______________________________;
②某高校提出用CH3OH-O2燃料电池作电源电解处理水泥厂产生的CO2(以熔融碳酸盐为介质),产物为C 和O2。其阳极电极反应式为___________________________。
-
工业上可通过煤的液化合成甲醇,主反应为:
CO(g)+2H2(g) CH3OH(l) △H=x。
CH3OH(l) △H=x。
(1)已知常温下CH3OH、H2和CO 的燃烧热分别为726.5 kJ/mol、285.5 kJ/mol、283.0 k J/mol,则x=____;为提高合成甲醇反应的选择性,关键因素是__________________________。
(2)TK下,在容积为1.00 L的某密闭容器中进行上述反应,相关数据如图一。
①该化学反应0~10 min的平均速率v(H2)=_______;M和N点的逆反应速率较大的是_____(填“v逆(M)”、“v逆(N)”或“不能确定”)。
②10 min时容器内CO的体积分数为______。

③对于气相反应,常用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)表示平衡常数(以KP表示),其中,pB=p总×B的体积分数;若在TK 下平衡气体总压强为x atm,则该反应KP=____(计算表达式)。实验测得不同温度下的lnK(化学平衡常数K 的自然对数)如图二,请分析1nK 随T呈现上述变化趋势的原因是________________。
(3)干燥的甲醇可用于制造燃料电池。
①研究人员发现利用NaOH 干燥甲醇时,温度控制不当会有甲酸盐和H2生成,其反应方程式为______________________________;
②某高校提出用CH3OH-O2燃料电池作电源电解处理水泥厂产生的CO2(以熔融碳酸盐为介质),产物为C 和O2。其阳极电极反应式为___________________________。
-
工业上可通过煤的液化合成甲醇,主反应为:CO(g)+2H2(g) CH3OH(l) △H=x。
CH3OH(l) △H=x。
(1)已知常温下CH3OH、H2和CO 的燃烧热分别为726.5kJ/mol、285.5 kJ/mol、283.0kJ/mol,则x=__。
(2)TK下,在容积为1.00L的某密闭容器中进行上述反应相关数据如图一。
①该化学反应0-10min的平均速率v(H2)=___。
②10min时容器内CO的体积分数为___。
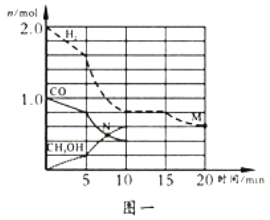
③对于气相反应,常用某组分(B)的平衡压强(pB)代替物质的量浓度(cB)表示平衡常数(以KP表示),其中,pB=p总×B的体积分数;若在TK下三种气体的平衡气体总压强为xMPa,则该反应Kp=__(计算表达式表示)。实验测得不同温度下的lnK(化学平衡常数K的自然对数)如图二,请分析lnK随T呈现上述变化趋势的原因是__。

(3)干燥的甲醇可用于制造燃料电池。
某高校提出用CH3OH-O2燃料电池作电源电解处理水泥厂产生的CO2(以熔融碳酸盐为介质),产物为C和O2。其阳极电极反应式为__。
-
工业上可通过煤的液化合成甲醇,主反应为:CO(g)+2H2(g)=CH3OH(l) △H=x
(1)己知常温下CH3OH、H2和CO的燃烧热分別为726.5kl/mo1、285.5kJ/mol、283.0kJ/mol,則x=_______;为提高合成甲醇反应的选择性,关键因素是___________。
(2)TK下,在容积为1.00 L的某密闭容器中进行上述反应(CH3OH为气体),相关数据如图。

①该反应0-10min的平均速率v(H2)=_______;M和N点的逆反应速率较大的是______(填“v逆(M)”、“v逆(N)”或“不能确定”) 。
②10min时容器内CO的体积分数为_______。相同条件下,若起始投料加倍,达平衡时,CO的体积分数将________(填“增大”、“减小”或“不变”)
③对于气相反应,常用某组分(B)的平衡压强(PB)代替物质的量浓度(CB)表示平衡常数(以Kp表示),其中,PB=P总×B的体积分数;若在TK下平衡气体总压强xatm,则该反应Kp=____(计算表达式)。实验测得不同温度下的lnK(化学平衡常数K的自然对数)如图,请分析lnK随T呈现上述变化趋势的原因是:____________。

-
(16分)甲醇是新型的汽车动力燃料。工业上可通过H2和CO化合制备甲醇,该反应的热化学方程式为:2H2(g)+CO(g) CH3OH(g)
CH3OH(g) 
(1)已知:



1 mol甲醇气体完全燃烧生成CO 和水蒸气的热化学方程式为________。
和水蒸气的热化学方程式为________。
(2)下列措施中有利于提高2H2(g)+CO(g) CH3OH(g)反应速率的是________(双选)。
CH3OH(g)反应速率的是________(双选)。
A.分离出CH3OH B.升高温度 C.减小压强 D.加入合适的催化剂
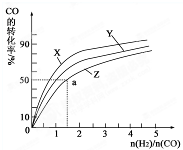
(3)(3)用H2和CO化合制备甲醇的反应中,若反应的容积为1L的恒容容器,分别在230℃、250℃和270℃下,改变H2和CO的起始组成比(起始时CO的物质的量固定为1mol)进行实验,结果如下图所示(图中曲线上的点都为一定温度下、一定组成下的平衡点):
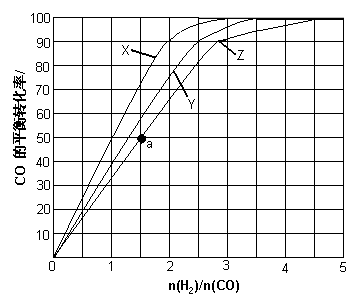
①曲线X对应的温度是________。
②从图中可以得出的结论有________(任写一条)。
(4)若往反应的容积中加入1.5molH2 和1.0molCO,在曲线Z对应温度下反应达平衡。利用上述图中a点对应的CO平衡转化率,计算2H2(g)+CO(g) CH3OH(g)的平衡常数。(写出计算过程)
CH3OH(g)的平衡常数。(写出计算过程)
-
甲醇是新型的汽车动力燃料。工业上可通过H2和CO化合制备甲醇,该反应的热化学方程式为: 2H2(g)+CO(g)  CH3OH(g) △H=-116kJ/mol
CH3OH(g) △H=-116kJ/mol
(1)已知: CO和H2的燃烧热分别为283kJ/mol、286kJ/mol 。1mol甲醇气体完全燃烧生成CO2和液态水的热化学方程式为_________________________________。
(2)下列措施中有利于提高2H2(g)+CO(g) CH3OH(g)反应速率及原料平衡转化率的是_____(填标号)。
CH3OH(g)反应速率及原料平衡转化率的是_____(填标号)。
A.分离出CH3OH B.升高温度 C.增大压强 D.加入合适的催化剂
(3)在容积为2L的恒容容器中,分别在230℃、250℃、270℃下,改变H2和CO的起始组成比[(n(H2)/n(CO)],起始时CO的物质的量固定为1mol,实验结果如图所示:
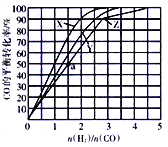
①Z曲线对应的温度是__________,判断的依据是________________。
②从图中可以得出的结论是(写两条)____________________、______________________。
(4)利用图中a点对应的数据,计算曲线Z对应温度下反应2H2(g)+CO(g) CH3OH(g)的平衡常数为____________;若在a点向容器中再充入1.5molCH3OH 和0.5mol H2,则原平衡___移动(填“向正反应方向”或“向逆反应方向”或“不”)
CH3OH(g)的平衡常数为____________;若在a点向容器中再充入1.5molCH3OH 和0.5mol H2,则原平衡___移动(填“向正反应方向”或“向逆反应方向”或“不”)
-
甲醇是新型的汽车动力燃料。工业上可通过H2和CO化合制备甲醇,该反应的热化学方程式为: 2H2(g)+CO(g)  CH3OH(g) △H=-116kJ/mol
CH3OH(g) △H=-116kJ/mol
(1)已知: CO和H2的燃烧热分别为283kJ/mol、286kJ/mol 。1mol甲醇气体完全燃烧生成CO2和液态水的热化学方程式为_________________________________。
(2)下列措施中有利于提高2H2(g)+CO(g) CH3OH(g)反应速率及原料平衡转化率的是_____(填标号)。
CH3OH(g)反应速率及原料平衡转化率的是_____(填标号)。
A.分离出CH3OH B.升高温度 C.增大压强 D.加入合适的催化剂
(3)在容积为2L的恒容容器中,分别在230℃、250℃、270℃下,改变H2和CO的起始组成比[(n(H2)/n(CO)],起始时CO的物质的量固定为1mol,实验结果如图所示:
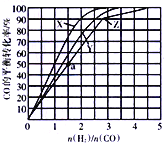
①Z曲线对应的温度是__________,判断的依据是________________。
②从图中可以得出的结论是(写两条)____________________、______________________。
(4)利用图中a点对应的数据,计算曲线Z对应温度下反应2H2(g)+CO(g) CH3OH(g)的平衡常数为____________;若在a点向容器中再充入1.5molCH3OH 和0.5mol H2,则原平衡___移动(填“向正反应方向”或“向逆反应方向”或“不”)
CH3OH(g)的平衡常数为____________;若在a点向容器中再充入1.5molCH3OH 和0.5mol H2,则原平衡___移动(填“向正反应方向”或“向逆反应方向”或“不”)
-
甲醇是一种很好的燃料,被称为21世纪的新型燃料.
工业上可通过H2和CO化合制备甲醇,该反应的热化学方程式为:
CO(g)+2H2(g)  CH3OH(g)△H1=-116kJ•molˉ1
CH3OH(g)△H1=-116kJ•molˉ1
(1)已知:CO(g)+ O2(g)=CO2(g)△H2=-283kJ•molˉ1
O2(g)=CO2(g)△H2=-283kJ•molˉ1
H2(g)+ O2(g)=H2O (g)△H3=-242kJ•molˉ1
O2(g)=H2O (g)△H3=-242kJ•molˉ1
1mol甲醇燃烧生成CO2和水蒸气放出________kJ的热量.
(2)在压强为0.1MPa条件下,将a mol CO与 3a mol H2的混合气体在催化剂作用下在VL容器中制备甲醇.
①若容器容积不变,下列措施可增加甲醇产率的是________.
A.升高温度 B.将CH3OH(g)从体系中分离
C.充入He,使体系总压强增大 D.再充入1mol CO和3mol H2
②为了寻找合成甲醇的温度和压强的适宜条件,某同学设计了三组实验,部分实验条件已经填在下面实验设计表中.
| 实验编号 | T(℃) | n(CO)/n(H2) | P(MPa) |
| 1 | 150 | 1/3 | 0.1 |
| 2 | a | 1/3 | 5 |
| 3 | 350 | b | 5 |
A.则上表中剩余的实验条件数据:a=________、b=________.
B.根据反应特点,右上图是在压强分别为0.1MPa和5MPa下CO的转化率随温度变化的曲线图,请指明图中的压强P1=________MPa.
③100℃时,CH3OH(g)  CO(g)+2H2(g)反应的平衡常数为________
CO(g)+2H2(g)反应的平衡常数为________
(用含a、V的代数式表示).
(3)科学家预言,燃料电池将是21世纪获得电力的重要途径,而甲醇燃料电池具备甲醇燃料容易携带、容易存储等优点,目前被认为将会替代传统的电池成为携带型设备的主要电源.右图是甲醇的质子交换膜型燃料电池模型.写出其电极反应式
正极:________
负极:________.


-
甲醇是一种新型燃料,甲醇燃料电池即将从实验室走向工业化生产.工业上一般以CO和H2为原料合成甲醇,该反应的热化学方程式为:CO(g)+2H2(g)⇌CH3OH(g)△H1=-116kJ•mol-1
(1)下列措施中有利于增大该反应的反应速率的是______.
A.随时将CH3OH与反应混合物分离 B.降低反应温度
C.增大体系压强 D.使用高效催化剂
(2)已知:CO(g)+ O2(g)═CO2(g)△H2=-283kJ•mol-1
O2(g)═CO2(g)△H2=-283kJ•mol-1
H2(g)+ O2(g)═H2O(g)△H3=-242kJ•mol-1
O2(g)═H2O(g)△H3=-242kJ•mol-1
则表示1mol气态甲醇完全燃烧生成CO2和水蒸气时的热化学方程式为:______.
(3)在容积为2L的恒容容器中,分别研究在230℃、250℃和270℃三种温度下合成甲醇的规律.下图是上述三种温度下不同的H2和CO的起始组成比(起始时CO的物质的量均为2mol)与CO平衡转化率的关系.请回答:
①在上述三种温度中,曲线Z对应的温度是______.
②利用图中a点对应的数据,计算出曲线Z在对应温度下CO(g)+2H2(g)⇌CH3OH(g) 的平衡常数K=______.
CH3OH(1) △H=xkJ/mol
CH3OH(g) △H<0,相关数据如图。












