-
通过以下反应均可获取H2。下列有关说法正确的是( )
①太阳光催化分解水制氢:2H2O(l)=2H2(g)+ O2(g) ΔH1=+571.6 kJ·mol-1
②焦炭与水反应制氢:C(s)+ H2O(g)=CO(g)+ H2(g) ΔH2=+131.3 kJ·mol-1
③甲烷与水反应制氢:CH4(g)+ H2O(g)=CO(g)+3H2(g) ΔH3=+206.1 kJ·mol-1
A.反应①中电能转化为化学能
B.反应②为放热反应
C.反应③使用催化剂,ΔH3减小
D.反应CH4(g)=C(s)+2H2(g)的ΔH=+74.8 kJ·mol-1
-
下列事实不能用键能的大小来解释的是 ( )
A.N元素的电负性较大,但N2的化学性质很稳定
B.稀有气体一般难发生化学反应
C.HF、HCl、HBr、HI的稳定性逐渐减弱
D.F2比O2更容易与H2反应
-
在解释下列物质性质的变化规律与物质结构间的因果关系中,与键的强弱无关的变化规律是( )
A.HF、HCl、HBr、HI的热稳定性依次减弱 B.NaF、NaCl、NaBr、NaI的熔点依次降低
C.F2、Cl2、Br2、I2的熔、沸点逐渐升高 D.H2S的稳定性小于H2O的稳定性
-
下列说法正确的是( )
A.氯化钾溶液在电流作用下电离成钾离子和氯离子
B.二氧化硫溶于水能部分转化成离子,故二氧化硫属于弱电解质
C.碳酸钡难溶于水,所以碳酸钡属于弱电解质
D.纯净的强电解质在液态时,有的导电有的不导电
-
下列变化中,不存在化学键断裂的是( )
A.氯化氢气体溶于水 B.干冰气化
C.氯化钠固体溶于水 D.氢气在氯气中燃烧
-
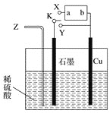
用铁片与稀硫酸反应制取氢气时,下列措施不能使氢气生成速率加大的是( )
A.对该反应体系加热 B.不用稀硫酸,改用98%的浓硫酸
C.向H2SO4中通入HCl气体 D.不用铁片,改用铁粉
-
某微粒的核外电子排布式为1s22s22p6,下列关于该微粒的说法一定正确的是( )
A.质子数为10 B.单质具有还原性
C.是单原子分子 D.电子数为10
-
元素在周期表中的位置,反映了元素的原子结构和元素的性质。下列说法正确的( )
A.同一元素不可能既表现金属性,又表现非金属性
B.第三周期元素的最高正化合价等于它所处的主族序数
C.短周期元素形成离子后,最外层都达到8电子稳定结构
D.同一主族的元素的原子,最外层电子数相同,化学性质完全相同
-
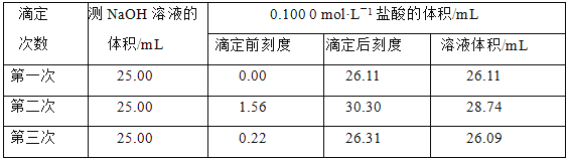
某温度时,在2 L容器中三种物质的物质的量随时间的变化曲线如图所示。由图中数据分析,该反应的化学方程式和反应开始至2 min末Z的平均反应速率分别为( )
A.X+3Y 2Z 0.1 mol• L-1•min-1 B.2X+Y
2Z 0.1 mol• L-1•min-1 B.2X+Y 2Z 0.1 mol• L-1•min-1
2Z 0.1 mol• L-1•min-1
C.X+2Y Z 0.05 mol• L-1•min-1 D.3X+Y
Z 0.05 mol• L-1•min-1 D.3X+Y 2Z 0.05 mol• L-1•min-1
2Z 0.05 mol• L-1•min-1
-
在一定条件下,发生CO + NO2(红色) CO2+ N2的反应,达到化学平衡后,降低温度,混合物的颜色变浅,下列说法正确的是
CO2+ N2的反应,达到化学平衡后,降低温度,混合物的颜色变浅,下列说法正确的是
A.正反应为吸热反应 B.正反应为放热反应
C.降温后CO的浓度增大 D.降温后各物质的浓度不变
-
某酸溶液中c(H+)=0.1 mol·L-1,则该溶液的物质的量浓度( )
A.一定等于0.1 mol·L-1 B.一定大于0.1 mol·L-1
C.一定小于0.1 mol·L-1 D.无法确定
-
科学家正在研究开发新的能源,如核能、太阳能、风能、地热、潮汐热等。“绿色能源”是目前正在研究的新能源之一,把高粱、玉米等绿色植物的种子经发酵、蒸馏就可以得到“绿色能源”中的一种。这种物质是
A.氢气 B.甲烷 C.酒精 D.木炭
-
下列有关盐类水解的说法不正确的是
A. 盐类的水解过程破坏了纯水的电离平衡
B. 盐类的水解是酸碱中和反应的逆过程
C. 盐类水解的结果使溶液不一定呈中性
D. Na2CO3水解的实质是Na+与H2O电离出的OH-结合生成了NaOH
-
右图是恒温下某化学反应的反应速率随反应时间变化的示意图。下列叙述与示意图不相符合的是( )
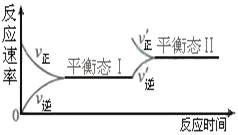
A.反应达平衡时,正反应速率和逆反应速率相等
B.该反应达到平衡态Ⅰ后,增大反应物浓度,平衡发生移动,达到平衡态Ⅱ
C.该反应达到平衡态后,减小反应物浓度,平衡发生移动,达到平衡态Ⅱ
D.同一种反应物在平衡态Ⅰ和平衡Ⅱ时浓度不相等
-
在容积为4 L的刚性密闭容器中,进行可逆反应:X(g)+2Y(g)⇌2Z(g)并达到平衡,在此过程中,以Y的浓度改变表示的反应速率υ(正)、υ(逆)与时间t的关系如图。则图中阴影部分的面积表示( )
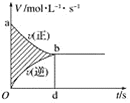
A.X的浓度的变化 B.Y的物质的量的变化
C.Z的浓度的变化 D.Z的物质的量的减少
-
生产液晶显示器过程中使用的化学清洗剂NF3是一种温室气体,其存储能量的能力是CO2的12 000~20 000倍,在大气中的寿命可长达740年之久,以下是几种化学键的键能:
| 化学键 | N≡N | F-F | N-F |
| 键能/kJ/mol | 941.7 | 154.8 | 283.0 |
下列说法中正确的是 ( )
A.过程N2(g)→2N(g)放出能量
B.过程N(g)+3F(g)→NF3(g)放出能量
C.反应N2(g)+3F2(g)→2NF3(g)的ΔH>0
D.NF3吸收能量后如果没有化学键的断裂与生成,仍可能发生化学反应
-
下列说法正确的是( )
①难溶电解质达到沉淀溶解平衡时,溶液中各种离子的溶解(或沉淀)速率都相等
②难溶电解质达到沉淀溶解平衡时,增加难溶电解质的量,平衡向溶解方向移动
③向Na2SO4溶液中加入过量的BaCl2溶液,则 沉淀完全,溶液中只含Ba2+、Na+和Cl-,不含
沉淀完全,溶液中只含Ba2+、Na+和Cl-,不含
④Ksp小的物质其溶解能力一定比Ksp大的物质的溶解能力小
⑤为减少洗涤过程中固体的损耗,最好选用稀H2SO4代替H2O来洗涤BaSO4沉淀
⑥洗涤沉淀时,洗涤次数越多越好
A.①②③ B.①②③④⑤⑥ C.⑤ D.①⑤⑥
-
下列各组物质中,按熔点由低到高的顺序排列正确的是( )
①O2、I2、Hg ②CO、Al、SiO2 ③Na、K、Rb ④Na、Mg、Al
A. ①③
B. ①④
C. ②③
D. ②④
-
下列说法正确的是
A.Na2O2晶体中,阴、阳离子个数比是1∶1
B.NaCl晶胞中有1个Na+和1个Cl-
C.CaF2晶体中,Ca2+和F-的配位数之比为1∶2
D.CsCl晶胞中,Cl-的配位数是8
-
下列元素原子半径最接近的一组是( )
A.Ne、Ar、Kr、Xe B.Mg、Cu、Sr、Ba
C.B、C、N、O D.Cr、Mn、Fe、Co
-
已知X、Y元素同周期,且电负性X>Y,下列说法错误的是( )
A.X与Y形成的化合物,X显负价,Y显正价
B.最高价含氧酸的酸性:X对应的酸的酸性强于Y对应的酸的酸性
C.气态氢化物的稳定性:HmY小于HnX
D.第一电离能Y一定小于X
-
下列对分子性质的解释中,不正确的是
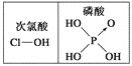
A. 水很稳定(1000 ℃以上才会部分分解)是因为水中含有大量的氢键所致
B. 乳酸(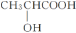 )分子中含有一个手性碳原子
)分子中含有一个手性碳原子
C. 碘易溶于四氯化碳,甲烷难溶于水都可用“相似相溶”原理解释
D. 由上图知酸性:H3PO4>HClO,因为H3PO4中非羟基氧原子数大于次氯酸中非羟基氧原子数
-
下列提供了有关物质的熔点,根据表中的数据,下列判断错误的是
| 物质 | NaCl | AlF3 | AlCl3 | MgCl2 | CO2 | SiO2 |
| 熔点/℃ | 801 | 1291 | 190(2.5×105Pa) | 714 | -56.5 | 1723 |
A.AlF3晶体是离子晶体,AlCl3晶体是分子晶体
B.AlF3晶体的晶格能小于NaCl晶体的晶格能
C.同族元素的氧化物可以形成不同类型的晶体
D.不同族元素的氯化物可以形成相同类型的晶体
-
下列关于化学键的叙述中正确的是( )
A.化学键存在于原子之间,也存在于分子之间
B.两个原子之间的相互作用叫做化学键
C.离子键是阴、阳离子之间的相互吸引力
D.化学键通常是指相邻的两个或多个原子之间强烈的相互作用
-
当H原子和F原子沿z轴结合成HF分子时,F原子中和H原子对称性不一致的轨道是( )
A.1s B.2s C.2px D.2pz
H2+2NiO(OH)。




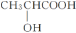 )分子中含有一个手性碳原子
)分子中含有一个手性碳原子