-
乙烯分子中含有4个C—H键和1个C=C键,6个原子在同一平面上。下列关于乙烯分子的成键情况分析正确的是 ( )
①每个C原子的2s轨道与2p轨道杂化,形成两个sp杂化轨道 ②每个C原子的2s轨道与2个2p轨道杂化,形成3个sp2杂化轨道 ③每个C原子的2s轨道与3个2p轨道杂化,形成4个sp3杂化轨道 ④每个C原子的3个价电子占据3个杂化轨道,1个价电子占据1个2p轨道
A. ①③ B. ②④ C. ①④ D. ②③
-
根据等电子原理判断,下列说法中错误的是( )
A. B3N3H6分子中所有原子均在同一平面上
B. B3N3H6分子中存在双键,可发生加成反应
C. H3O+和NH3是等电子体,均为三角锥形
D. CH4和NH4+是等电子体,均为正四面体
-
第三周期元素中,微粒半径最大的是( )
A. Na+ B. Al3+ C. S2- D. Cl-
-
自由能的变化(ΔG)是反应方向判断的复合判据:ΔG=ΔH-TΔS,ΔG<0时,反应正向自发进行。已知某化学反应其ΔH=-122 kJ·mol-1,ΔS=231 J·mol-1·K-1,则此反应在下列哪种情况下可自发进行 ( )。
A.在任何温度下都能自发进行 B.在任何温度下都不能自发进行
C.仅在高温下自发进行 D.仅在低温下自发进行
-
离子晶体熔点的高低决定于阴、阳离子之间距离、晶格能的大小,据所学知识判断KCl、NaCl、CaO、BaO四种晶体熔点的高低顺序是( )
A.KCl>NaCl>BaO>CaO B.NaCl>KCl>CaO>BaO
C.CaO>BaO>KCl>NaCl D.CaO>BaO>NaCl>KCl
-
有关晶格能的叙述不正确的是( )
A.1mol气态金属阳离子离子和1mol气态阴离子离子结合生成1mol离子晶体时释放出的热能为离子晶体的晶格能
B.晶格能通常取正值
C.晶格能越大,形成的离子晶体越稳定
D.晶格能越大,物质的硬度反而越小
-
热方程式C(s)+H2O(g)=CO(g)+H2(g)ΔH=131.3 kJ·mol-1表示( )
A. 碳和水反应吸收131.3kJ能量
B. 1mol碳和1mol水反应生成1mol一氧化碳和1mol氢气,并吸收131.3kJ热量
C. 1mol固态碳和1mol水蒸气反应生成1mol一氧化碳和1 mol氢气,并吸收131.3kJ热量
D. 1个固态碳原子和1分子水蒸气反应吸收131.3kJ热量
-
X是核外电子数最少的元素,Y是地壳中含量最丰富的元素,Z在地壳中的含量仅次于Y,W可以形成自然界中最硬的原子晶体。下列叙述错误的是( )
A.WX4是沼气的主要成分 B.固态X2Y是分子晶体
C.ZW是原子晶体 D.玛瑙、水晶和玻璃的成分都是ZY2
-
在下列各说法中,正确的是
A. ΔH>0表示放热反应,ΔH<0表示吸热反应
B. 热化学方程式中的化学计量数只表示物质的量,可以是分数
C. 1 mol H2SO4与1 mol Ba(OH)2反应生成BaSO4沉淀时放出的热叫做中和热
D. 1 mol H2与0.5 mol O2反应放出的热就是H2的燃烧热
-
可逆反应N2+3H2 2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
2NH3的正、逆反应速率可用各反应物或生成物浓度的变化来表示。下列各关系中能说明反应已达到平衡状态的是( )
A.3v正(N2)=v正(H2) B.v正(N2)=v逆(NH3)
C.2v正(H2)=3v逆(NH3) D.v正(N2)=3v逆(H2)
-
CaCO3在下列液体中溶解度最大的是
A.H2O B.Na2CO3溶液 C.CaCl2溶液 D.乙醇
-
物质的量浓度相同的200mLBa(OH)2溶液和150mLNaHCO3混合后,最终溶液中离子的物质的量浓度关系正确的是( )
A.c(OH-)>c(Ba2+)>c(Na+)>c(CO32-) B.c(OH-)>c(Na+)>c(Ba2+)>c(H+)
C.c(OH-)=c(Ba2+)+c(Na+)+c(H+) D.c(H+)+c(Na+)+c(Ba2+)=c(OH-)+c(CO32-)
-
下列说法正确的是( )
A.凡是放热反应都是自发的,凡是吸热反应都是非自发的
B.自发反应一定是放热反应,非自发反应一定是吸热反应
C.自发反应在恰当条件下才能实现
D.自发反应在任何条件下都能实现
-
用电解法提取氯化铜废液中的铜,方案正确的是( )
A.用铜片连接电源的正极,另一电极用铂片
B.用碳棒连接电源的正极,另一电极用铜片
C.用氢氧化钠溶液吸收阴极产物
D.用带火星的木条检验阳极产物
-
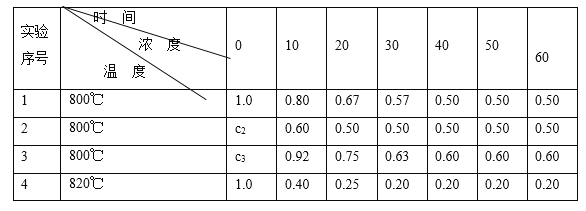
电镀废液中Cr2O72-可通过下列反应转化成铬黄(PbCrO4):Cr2O72-(aq)+2Pb2+(aq)+H2O(l) 2PbCrO4(s)+2H+(aq) ΔH<0该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( )
2PbCrO4(s)+2H+(aq) ΔH<0该反应达平衡后,改变横坐标表示的反应条件,下列示意图正确的是( )
A.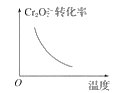 B.
B.
C. D.
D.
-
已知K2HPO4溶液呈碱性,即HPO42-结合H+的能力大于其电离产生H+的能力。下列操作能使该溶液中c(H3O+)增大的是( )
A.加水 B.加热 C.加消石灰 D.加K2HPO4
-
可逆反应:3A(g) 3B(?)+C(?) ΔH>0,随着温度升高,气体平均相对分子质量有减小趋势,则下列判断正确的是( )
3B(?)+C(?) ΔH>0,随着温度升高,气体平均相对分子质量有减小趋势,则下列判断正确的是( )
A.B和C可能都是固体 B.B和C一定都是气体
C.若C为固体,则B一定是气体 D.B和C一定都不是气体
-
某小组设计电解饱和食盐水的装置如图,通电后两极均有气泡产生,下列叙述正确的是

A. 铜电极附近观察到黄绿色气体
B. 石墨电极附近溶液呈红色
C. 溶液中的Na+向石墨电极移动
D. 铜电极上发生还原反应
-
下列叙述中正确的是
A.以非极性键结合起来的双原子分子一定是非极性分子
B.以极性键结合起来的分子一定是极性分子
C.非极性分子只能是双原子单质分子
D.非极性分子中,一定含有非极性共价键
-
下列原子轨道上的电子,在xy平面上的电子云密度为零的是( )
A.3s B.3px C.3pz D.3py
-
能与氢氧化钠溶液反应且属化合物的原子晶体是( )
A. 铝 B. 金刚石 C. 硅 D. 二氧化硅
-
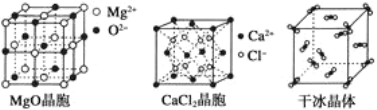
某离子晶体的晶体结构示意图如图,晶体中氧的化合价可看作部分为0价,部分为﹣2价。则下列说法错误的是( )
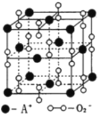
A.晶体中与每个A+距离最近的A+有12个
B.晶体中,阴离子与阳离子个数之比为1︰1
C.该离子晶体化学式为A2O2
D.晶体中,0价氧原子与﹣2价氧原子的数目比为3︰1
-
短周期元素X、Y 在周期表中的相对位置如图所示,且己知Y基态原子的价电子层为nsn-1npn+1,下列说法不正确的是
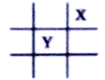
A. X元素的电负性大于Y的 B. X元素的第一电离能大于Y的
C. Y在周期表中位于第三周期第VIA族 D. 原子半径:Mg<X
-
某固体仅由一种元素组成,其密度为5.0 g·cm-3。用X射线研究该固体的结构时得知:在边长为10-7cm的正方体中含有20个原子,则此元素的相对原子质量最接近于下列数据中的( )。
A.32 B.120 C.150 D.180
-
.在高压下氮气会发生聚合得到高聚氮,这种高聚氮的N—N键的键能为160kJ·mol-1(N2的键能为942kJ·mol-1),晶体片段结构如右图所示。又发现利用N2可制取出N5、N3。含N5+离子的化合物及N60、N5极不稳定。则下列说法错误的是( )
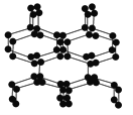
A. 按键型分类,该晶体中含有非极性共价键
B. 含N5+离子的化合物中既有离子键又有共价键
C. 高聚氮与N2、N3、N5、N5+、N60互为同素异形体
D. 这种固体的可能潜在应用是烈性炸药或高能材料

 B.
B.