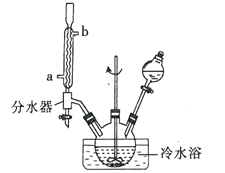
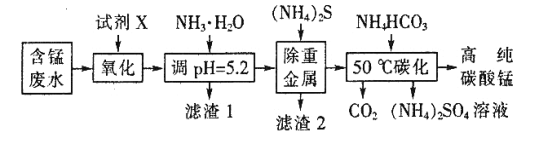
-
已知下列实验事实:
①Cr2O3固体既能溶于KOH溶液得到KCrO2溶液,又能溶于硫酸得到Cr2(SO4)3溶液;
②向KCrO2溶液中滴加H2O2溶液,再酸化,可得K2Cr2O7溶液;
③将K2Cr2O7溶液滴加到淀粉和KI的混合溶液中,溶液变蓝。
下列判断不正确的是
A.化合物KCrO2中Cr元素为+3价
B.实验①证明Cr2O3是两性氧化物
C.实验②证明H2O2既有氧化性又有还原性
D.实验③证明氧化性:Cr2O72- > I2
难度: 中等查看答案及解析
-
化学与生产生活、环境保护、资源利用等密切相关,下列说法正确的是
A.大米、玉米、小麦中的淀粉经水解可变成乙醇
B.棉花、蚕丝和人造丝的主要成分都是纤维素
C.利用二氧化碳制造全降解塑料,可以缓解温室效应
D.海洋中含有丰富的矿产资源,仅利用物理方法就可以获得NaCl、Br2和Mg等物质
难度: 简单查看答案及解析
-
实验是化学研究的基础,下图装置或操作正确的是
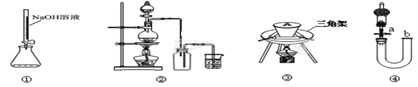
A.用装置①量取15.00mL的NaOH溶液
B.用装置②制备Cl2
C.用装置③陶瓷坩埚高温煅烧CaCO3固体
D.关闭活塞a,从b处加水,以检查装置④的气密性
难度: 中等查看答案及解析
-
X、Y、Z、Q、W均为短周期元素,原子序数逐渐增大。X、Q同主族,Q元素的焰色反应为黄色;W的原子半径是同周期中最小的;X与Y、Z分别形成化合物甲、乙,甲、乙均由10电子分子构成,且能发生反应生成碱。下列说法不正确的是
A.X的单质和Q的单质均可用电解法得到
B.Z与Q形成的化合物只含有离子键
C.Q与W形成的化合物熔化或溶于水时均可发生电离
D.X、Y、Z三种元素形成的化合物可能是离子化合物
难度: 简单查看答案及解析
-
标准状况下,向2mol·L-1的NaOH溶液100mL中缓缓通入4.48LCO2气体,充分反应后溶液中离子浓度大小排列顺序正确的是
A.c(Na+)>c(
)>c(OH-)>c(H+) B.c(Na+)+ c(H+)=c(
)+ c(OH-)
C.c(Na+)>c(
)>c(H+)>c(OH-) D.c(Na+)=c(
)>c(OH-)>c(H+)
难度: 简单查看答案及解析
-
有一种有机物,因其酷似奥林匹克旗中的五环(如图),科学家称其为奥林匹克烃,下列有关奥林匹克烃的说法正确的是
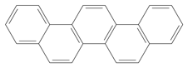
A.该烃的一氯代物只有一种
B.该烃分子中只含非极性键
C.该烃完全燃烧生成H2O的物质的量小于CO2的物质的量
D.该烃属于苯的同系物
难度: 简单查看答案及解析
-
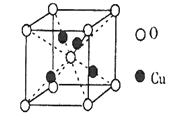
工业上电解法处理含镍酸性废水并得到单质Ni的原理如图所示:
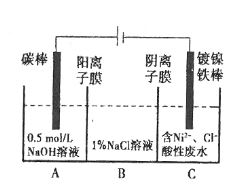
已知:①Ni2+在弱酸性溶液中发生水解②氧化性:Ni2+(高浓度)>H+>Ni2+(低浓度)。下列说法不正确的是
A.碳棒上发生的电极反应:4OH-—4e-=O2↑+2H2O
B.为了提高Ni的产率,电解过程中需要控制废水pH
C.电解过程中,B中NaCl溶液的物质的量浓度将不断减少
D.若将图中阳离子膜去掉,将A、B两室合并,则电解反应总方程式发生改变
难度: 简单查看答案及解析
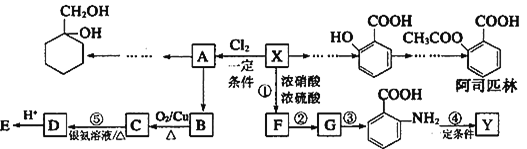

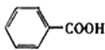
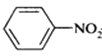
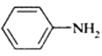 (苯胺,易被氧化)
(苯胺,易被氧化)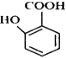 有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有______种。
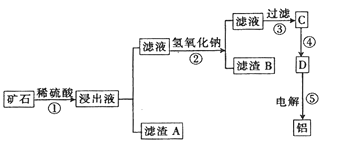
有多种同分异构体,其中含有1个醛基和2个羟基的芳香族化合物共有______种。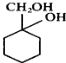 的流程图:A
的流程图:A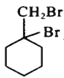
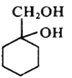 。甲→乙反应的化学方程式为________。
。甲→乙反应的化学方程式为________。