-
当前,全球资源紧张、气候变暖已对人类的生存和发展形成了严峻的挑战。发展低碳经济、倡导低碳生活是形势所迫,更是大势所趋。请运用化学反应原理的相关知识研究碳及其化合物的性质。
(1)工业上将CO2与焦炭作用生成CO,CO可用于炼铁,其反应原理为:
①Fe2O3(s)+3C(s)=2Fe(s)+3CO(g) ΔH1=+489.0kJ·mol-1
②C(s)+CO2(g)=2CO(g) ΔH2=+172.5 kJ·mol-1
则CO还原Fe2O3的热化学方程式为___________。
(2)适当条件下将CO2和H2以1:3的体积比混合合成甲醇和水:CO2(g)+3H2(g)⇌CH3OH(g) +H2O(g) ΔH =-49.0 kJ·mol-1。在体积为2 L的密闭容器中,充入2 mol CO2和6 mol H2,测得CO2(g)和CH3OH(g)的浓度随时间变化如图所示:
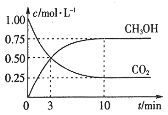
①该反应的平衡常数表达式为________。
②从反应开始到平衡, (H2)=______;氢气的转化率=______;能使平衡体系中n(CH3OH)增大的措施是___________。
(H2)=______;氢气的转化率=______;能使平衡体系中n(CH3OH)增大的措施是___________。
(3)CO还可以用作燃料电池的燃料,某熔融盐燃料电池具有高的发电效率,因而受到重视,该电池用Li2CO3和Na2CO3的熔融盐混合物作电解质,CO为负极燃气,空气与CO2的混合气为正极助燃气,其负极反应式为:2CO-4e-+2 =4CO2,则正极反应式为__________。
=4CO2,则正极反应式为__________。
(4)CO2在自然界循环时可与CaCO3反应,CaCO3是一种难溶物质,其Ksp =3.8×10-9。CaCl2溶液与Na2CO3溶液混合可形成CaCO3沉淀,现将等体积的CaCl2溶液与Na2CO3溶液混合(忽略混合后溶液体积的变化),若Na2CO3溶液的浓度为2×10-4mol·L-1,则生成沉淀所需CaCl2溶液的最小浓度为___________。
-
近年来,全球气候变暖给人类的生存和发展带来了严峻的挑战,在此背景下,“新能源”、“低碳”、“节能减排”、“吃干榨尽”等概念愈来愈受到人们的重视。下列有关说法不正确的是( )
A.太阳能、地热能、生物质能和核聚变能均属于“新能源”
B.“低碳”是指采用含碳量低的烃类作为燃料
C.下图甲烷经一氯甲烷生成低碳烯烃的途径体现了“节能减排”思想

D.让煤变成合成气,把煤“吃干榨尽”,实现了煤的清洁、高效利用
-
CO2是生活中常见的化合物之一,随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,人类对CO2的性质研究和综合利用日益重视。
Ⅰ.在催化剂作用下,可由甲醇和CO2直接合成碳酸二甲酯(DMC):CO2 + 2CH3OH → CO(OCH3)2 + H2O,但甲醇转化率通常不会超过1%,这是制约该反应走向工业化的主要原因。某研究小组在其他条件不变的情况下,通过研究温度、反应时间、催化剂用量分别对转化数(TON)的影响来评价催化剂的催化效果。计算公式为:TON=转化的甲醇的物质的量/催化剂的物质的量。
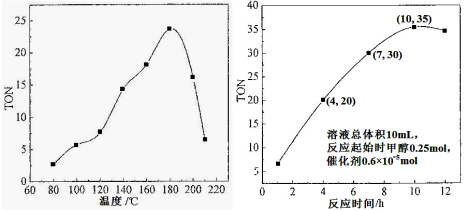
(1)根据反应温度对TON的影响图(相同时间内测定),判断该反应的焓变△H________0(填“>”、“=”或“<”),理由是____________________________________。
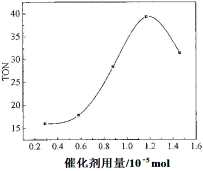
(2)根据反应时间对TON的影响图(上图),已知溶液总体积10mL,反应起始时甲醇0.25mol,催化剂0.6×10—5 mol,计算该温度下,4~7 h内DMC的平均反应速率:________。
(3)根据该研究小组的实验及催化剂用量对TON的影响图(见上右图),判断下列说法正确的是 。
A.由甲醇和CO2直接合成DMC,可以利用甲醇把影响环境的温室气体CO2 转化为资源,在资源循环利用和环境保护方面都具有重要意义
B. 在反应体系中添加合适的脱水剂,将提高该反应的TON
C. 当催化剂用量低于1.2×10—5 mol时,随着催化剂用量的增加,甲醇的平衡转化率显著提高
D. 当催化剂用量高于1.2×10—5 mol时,随着催化剂用量的增加DMC的产率反而急剧下降
Ⅱ.如果人体内的CO2不能顺利排除体外会造成酸中毒,缓冲溶液可以抵御外来少量酸或碱对溶液pH的影响,人体血液里主要通过碳酸氢盐缓冲体系(H2CO3/HCO3-)维持pH稳定。己知正常人体血液在正常体温时,H2CO3的一级电离常数Ka1=10-6.1,c(HCO3-):c(H2CO3)≈20:1,lg2=0.3。
(4)由题给数据可算得正常人体血液的pH________(保留一位小数)。
(5)正常人体血液中H2CO3、HCO3-、OH- 、H+四种微粒浓度由大到小关系为: 。
(6)当少量的酸、碱进入血液中时,血液pH变化不大,其原因是 。
-
2009年底在丹麦哥本哈根召开了全球气候会议。大力倡导“低碳经济”;2010年5月至10月将在上海举办世博会,也推崇“低碳世博”。下列有关说法正确的是 ( )
A.大力发展绿色经济,告别含碳物质
B.尽量节约能源,推广使用新能源,减少二氧化碳的排放
C.尽量使用含12C的产品,减少使用含13C或14C的产品
D.逐步推广天然气,代替石油和煤的使用
-
2009年底在丹麦哥本哈根召开了全球气候会议.大力倡导“低碳经济”;2010年5月至
10月将在上海举办世博会,也推崇“低碳世博”.下列有关说法正确的是( )
A.大力发展绿色经济,告别含碳物质
B.尽量节约能源,推广使用新能源,减少二氧化碳的排放
C.尽量使用含12C的产品,减少使用含13C或14C的产品
D.逐步推广天然气,代替石油和煤的使用
-
随着世界工业经济的发展、人口的剧增,全球能源紧张及世界气候面临越来越严重的问题,如何降低大气中CO2的含量及有效地开发利用CO2引起了全世界的普遍重视。
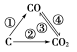
(1)如图为C及其氧化物的变化关系图,若①变化是置换反应,则其化学方程式可为______________________________________;
图中变化过程哪些是吸热反应________(填序号)。
(2)甲醇是一种可再生能源,具有开发和应用的广阔前景,工业上可用如下方法合成甲醇:
方法一 CO(g)+2H2(g)CH3OH(g)
方法二 CO2(g)+3H2(g)CH3OH(g)+H2O(g)
在25℃、101 kPa下,1克甲醇完全燃烧放热22.68 kJ,写出甲醇燃烧的热化学方程式:_____________________________________________;
某火力发电厂CO2的年度排放量是2 200万吨,若将此CO2完全转化为甲醇,则理论上由此获得的甲醇完全燃烧放热约是________kJ(保留三位有效数字)。
(3)金属钛冶炼过程中其中一步反应是将原料金红石转化:TiO2(金红石)+2C+2Cl2高温,TiCl4+2CO 已知:C(s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ·mol-1
TiO2(s)+2Cl2(g)=TiCl4(s)+O2(g) ΔH=+141 kJ·mol-1
则TiO2(s)+2Cl2(g)+2C(s)=TiCl4(s)+2CO(g)的ΔH=________。
(4)臭氧可用于净化空气,饮用水消毒,处理工业废物和作为漂白剂。臭氧几乎可与除铂、金、铱、氟以外的所有单质反应。如:
6Ag(s)+O3(g)=3Ag2O(s) ΔH=-235.8 kJ·mol-1,
已知:2Ag2O(s)=4Ag(s)+O2(g)ΔH=+62.2 kJ·mol-1,
则O3转化为O2的热化学方程式为_________________________。
-
能源问题是当前世界各国所面临的严重问题,同时全球气候变暖,生态环境问题日益突出,开发氢能、研制燃料电池、发展低碳经济是化学工作者的研究方向。
I.氢气通常用生产水煤气的方法制得。其中CO(g)+H2O(g)  CO2(g)+H2(g)
CO2(g)+H2(g)
△H<0。在850℃时,平衡常数K=1。
(1)若降低温度到750℃时,达到平衡时K________1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0molCO、3molH2O、1.0molCO2
和x molH2,则:
①当x=5.0时,上述反应向(填“正反应”或“逆反应”)方向进行。
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是________。
③在850℃时,若设x=5.0和x=6.0,其它物质的投料不变,当上述反应达到平衡后,
测得H2的体积分数分别为a%、b%,则a________b(填“大于”、“小于”或“等于”)
II.已知4.6g液态乙醇完全燃烧生成二氧化碳和液态水放出热量136kJ·mol液态水转
化为气体水吸收44kJ的热量。
(3)请写出乙醇燃烧生成气态水的热化学方程式
。
(4)将0.1mol乙醇在足量氧气中燃烧,得到的气体全部通入到100mL3mol/LNaOH溶液中,忽略HCO-3的电离,则所得溶液中c(CO2-3)________c(HCO-3)(填“大于”、“小于”或“等于”,)原因是________(用文字叙述)。
-
能源问题是当前世界各国所面临的严重问题,同时全球气候变暖,生态环境问题日益突出,开发氢能、研制燃料电池、发展低碳经济是化学工作者的研究方向.
I.氢气通常用生产水煤气方法制得.其中CO(g)+H2O(g)⇌CO2(g)+H2(g)△H<0.在850℃时,平衡常数K=1.
(1)若降低温度到750℃时,达到平衡时K______1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO、3mol H2O、1.0mol CO2和x mol H2,则:
①当x=5.0时,上述反应向______(填“正反应”或“逆反应”)方向进行.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是______.
③在850℃时,若设x=5.0和x=6.0,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a______b(填“大于”、“小于”或“等于”)
II.已知4.6g液态乙醇完全燃烧生成二氧化碳和液态水放出热量136kJ,1mol液态水转化为气体水吸收44kJ的热量.
(3)请写出乙醇燃烧生成气态水的热化学方程式______.
(4)将0.1mol乙醇在足量氧气中燃烧,得到的气体全部通入到100mL 3mol/L NaOH溶液中,忽略HCO-3的电离,则所得溶液中c(CO2-3)______c(HCO-3)(填“大于”、“小于”或“等于”,)原因是______(用文字叙述).
-
能源问题是当前世界各国所面临的严重问题,同时全球气候变暖,生态环境问题日益突出,开发氢能、研制燃料电池、发展低碳经济是化学工作者的研究方向.
I.氢气通常用生产水煤气方法制得.其中CO(g)+H2O(g)⇌CO2(g)+H2(g)△H<0.在850℃时,平衡常数K=1.
(1)若降低温度到750℃时,达到平衡时K______1(填“大于”、“小于”或“等于”)
(2)850℃时,若向一容积可变的密闭容器中同时充入1.0mol CO、3mol H2O、1.0mol CO2和x mol H2,则:
①当x=5.0时,上述反应向______(填“正反应”或“逆反应”)方向进行.
②若要使上述反应开始时向正反应方向进行,则x应满足的条件是______.
③在850℃时,若设x=5.0和x=6.0,其它物质的投料不变,当上述反应达到平衡后,测得H2的体积分数分别为a%、b%,则a______b(填“大于”、“小于”或“等于”)
II.已知4.6g液态乙醇完全燃烧生成二氧化碳和液态水放出热量136kJ,1mol液态水转化为气体水吸收44kJ的热量.
(3)请写出乙醇燃烧生成气态水的热化学方程式______.
(4)将0.1mol乙醇在足量氧气中燃烧,得到的气体全部通入到100mL 3mol/L NaOH溶液中,忽略HCO-3的电离,则所得溶液中c(CO2-3)______c(HCO-3)(填“大于”、“小于”或“等于”,)原因是______(用文字叙述).
-
2019年世界地球日的中国主题是“珍惜地球资源,转变发展方式,倡导低碳生活”。下列说法正确的是( )
A.垃圾分类处理,实现资源再利用 B.焚烧废旧塑料,消除“白色污染”
C.减少二氧化碳排放,防止形成酸雨 D.施用大量农药,提高农作物产量

(H2)=______;氢气的转化率=______;能使平衡体系中n(CH3OH)增大的措施是___________。
=4CO2,则正极反应式为__________。



