-
景泰蓝是一种传统的手工艺品。下列制作景泰蓝的步骤中,不涉及化学变化的是
A
B
C
D

将铜丝压扁,掰成图案

将铅丹、硼酸盐等化合熔制后描绘
高温焙烧
酸洗去污A. A B. B C. C D. D
难度: 简单查看答案及解析
-
下列表示反应中相关微粒的化学用语正确的是
A.中子数为18的氯原子:
Cl B.N2的结构式:N═N
C.H2O的电子式:
D.Na+的结构示意图:
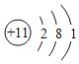
难度: 中等查看答案及解析
-
下列物质在生活中应用时,起还原作用的是( )
A.明矾作净水剂 B.甘油作护肤保湿剂
C.漂粉精作消毒剂 D.铁粉作食品袋内的脱氧剂
难度: 简单查看答案及解析
-
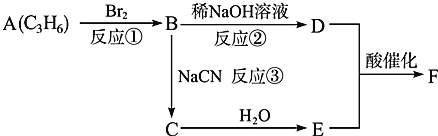
某废水中含有的NH
在一定条件下可被O2氧化,反应过程如下:
①NH4+(aq)+3/2O2(g)=NO2-(aq)+2H+(aq)+H2O(l) ΔH = -273kJ/mol
②NO2-(aq)+1/2O2(g)=NO3-(aq) ΔH = -73kJ/mol
下列叙述不正确的是
A.1mol的NH3和1mol 的NH4+都有10×6.02×1023个电子
B.室温下,0.1 mol/L HNO2溶液pH>1,则NaNO2溶液显碱性
C.NH4+(aq)+2O2(g)=NO3-(aq)+2H+(aq)+H2O(l) ΔH= -346kJ/mol
D.在上述两次转化过程中,废水的酸性先增大然后逐渐减弱
难度: 困难查看答案及解析
-
丙烯是一种常见的有机物。下列有关丙烯的化学用语中,不正确的是
A.实验式 CH2 B.聚合后的结构简式:
C.球棍模型
D.结构简式:CH2=CHCH3
难度: 中等查看答案及解析
-
下列离子方程式能用来解释相应实验现象的是( )
实验现象
离子方程式
A
向氢氧化镁悬浊液中滴加氯化铵溶液,沉淀溶解
B
向沸水中滴加饱和氯化铁溶液得到红褐色液体
C
二氧化硫使酸性高锰酸钾溶液褪色
D
氧化亚铁溶于稀硝酸
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
今年是门捷列夫发现元素周期律150周年。下表是元素周期表的一部分,W、X、Y、Z为短周期主族元素,W与X的最高化合价之和为8。下列说法错误的是
A.原子半径:W<X
B.常温常压下,Y单质为固态
C.气态氢化物热稳定性:Z<W
D.X的最高价氧化物的水化物是强碱
难度: 中等查看答案及解析
-
氮及其化合物的转化过程如图所示。下列分析合理的是
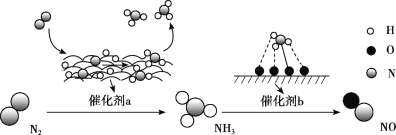
A. 催化剂a表面发生了极性共价键的断裂和形成
B. N2与H2反应生成NH3的原子利用率为100%
C. 在催化剂b表面形成氮氧键时,不涉及电子转移
D. 催化剂a、b能提高反应的平衡转化率
难度: 简单查看答案及解析
-
利用生物燃料电池原理研究室温下氨的合成,电池工作时MV2+/MV+在电极与酶之间传递电子,示意图如图所示。下列说法错误的是
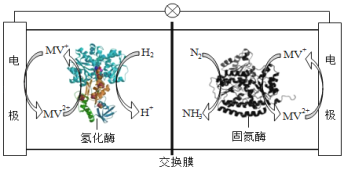
A.相比现有工业合成氨,该方法条件温和,同时还可提供电能
B.正极区,在氢化酶作用下发生反应H2+2MV2+═2H++2MV+
C.正极区,固氮酶为催化剂,N2发生还原反应生成NH3
D.电池工作时质子通过交换膜由负极区向正极区移动
难度: 中等查看答案及解析
-
苯丙炔酸(
)广泛用于医药、香料等化工产品中。下列关于苯丙炔酸的说法正确的是
A.分子式为C9H7O2
B.与丙炔酸(CH≡C—COOH)互为同系物
C.是
的单体
D.1 mol苯丙炔酸最多可与4mol氢气发生反应
难度: 中等查看答案及解析
-
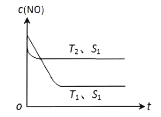
一定条件下,将NO(g)和O2(g)按物质的量之比2∶1充入反应容器,发生反应:2NO(g) + O2(g)
2NO2(g)。其他条件相同时,分别测得NO的平衡转化率在不同压强(p1、p2)下随温度变化的曲线如下图所示。下列说法正确的是

A. p1 < p2
B. 其他条件不变,温度升高,该反应的反应限度增大
C. 400℃、p1条件下,O2的平衡转化率为20%
D. 400℃时,该反应的化学平衡常数的数值为10/9
难度: 中等查看答案及解析
-
利用Cu和浓硫酸制备SO2的反应涉及的装置,下列说法正确的是
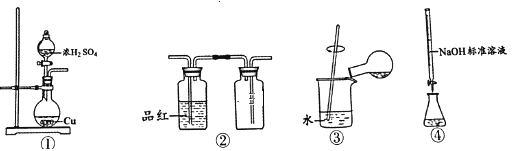
A. 用装置①制备SO2 B. 用装置②检验和收集SO2
C. 用装置③稀释反应后溶液 D. 用装置④测定反应后溶液中c(H+)
难度: 简单查看答案及解析
-
室温条件下进行下列各组实验,其中的观察要点不能说明醋酸是弱电解质的是
选项
实验方案
观察要点
A
等浓度的醋酸与氢氧化钠溶液反应
恰好反应时的体积比
B
醋酸溶液中加入醋酸钠固体
溶液pH的变化
C
等体积等浓度的盐酸和醋酸分别和等量镁条反应
产生H2的起始速率
D
将pH=4的醋酸稀释成pH=6的溶液
加H2O的量
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某小组同学通过实验研究FeCl3溶液与Cu粉发生的氧化还原反应。实验记录如下:
序号
I
II
III
实验步骤
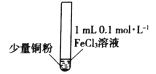
充分振荡,加入2mL蒸馏水
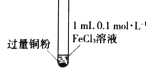
充分振荡,加入2mL蒸馏水
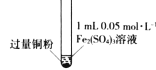
充分振荡,加入2mL蒸馏水
实验现象
铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象
铜粉有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀
铜粉有剩余,溶液黄色褪去,变成蓝色,加入蒸馏水后无白色沉淀
下列说法不正确的是
A.实验I、II、III中均涉及Fe3+被还原
B.对比实验I、II说明白色沉淀的产生与铜粉的量有关
C.实验II、III中加入蒸馏水后c(Cu2+)相同
D.向实验III反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
难度: 困难查看答案及解析