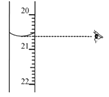
-
用浓氯化铵溶液处理过的舞台幕布不易着火。其原因是 ( )
①幕布的着火点升高 ②幕布的质量增加
③氯化铵分解吸收热量,降低了温度 ④氯化铵分解产生的气体隔绝了空气
A.①② B.③④ C.①③ D.②④
难度: 简单查看答案及解析
-
将空气中氮气转化成氮的化合物的过程称为固氮。下图中能实现人工固氮的是( )
A. 闪电
 B. 电解食盐水车间
B. 电解食盐水车间
C. 根瘤菌
 D. 合成氨车间
D. 合成氨车间
难度: 简单查看答案及解析
-
据报道,科学家已成功合成了少量N4,有关N4的说法正确的是( )
A.N4是N2的同素异形体 B.N4是N2的同分异构体
C.相同质量的N4和N2所含原子个数比为1︰2 D.N4的摩尔质量是56g
难度: 中等查看答案及解析
-
物质的量之比为2:5的锌与稀硝酸反应,若硝酸被还原的产物为N2O,反应结束后锌没有剩余,则该反应中被还原的硝酸与未被还原的硝酸的物质的量之比是
A.1:4 B.4:1 C.2:3 D.2:5
难度: 中等查看答案及解析
-
将22.4L某气态氮氧化合物与足量的灼热铜粉完全反应后,气体体积变为11.2L(体积均在相同条件下测定),则该氮氧化合物的化学式为
A.NO2 B.N2O5 C.N2O D.N2O4
难度: 困难查看答案及解析
-
已知25%氨水的密度为0.91 g·cm-3,5%氨水的密度为0.98 g·cm-3,若将上述两溶液等体积混合,所得氨水溶液的质量分数是
A.等于15% B.大于15% C.小于15% D.无法估算
难度: 中等查看答案及解析
-
将NH4HCO3置于干的试管中加热,并使放出的气体依次通过盛有足量过氧化钠和碱石灰的干燥管,最后得到的气体有( )
A.NH3、O2 B.H2O、O2 C.CO2、O2 D.O2
难度: 中等查看答案及解析
-
下列物质的水溶液中,除了水分子外,不存在其他分子的是
A.NaHSO3 B.NH4NO3 C.HNO3 D.CH3COONa
难度: 简单查看答案及解析
-
下列说法正确的是
A.分子内共价键越强,分子越稳定,其形成的晶体的熔沸点也越高
B.离子键的本质就是阴、阳离子之间的相互吸引
C.金刚石转化为石墨的过程中不存在化学键被破坏的过程
D.由原子构成的晶体可能是原子晶体,也可能是分子晶体
难度: 中等查看答案及解析
-
下表为元素周期表的一部分。X、Y、Z、W为短周期元素,其中X元素的原子最外层电子数是其内层电子数的2倍。下列说法不正确的是
X
Y
Z
W
T
A.Y氢化物的热稳定性比X氢化物的热稳定性高
B.W的最高价氧化物的水化物酸性比Z的强
C.原子半径(r)大小比较:r(W)>r(Z)>r(Y)>r(X )
D.根据元素周期律,可以推测存在T3Y4、TZ2和TW4
难度: 中等查看答案及解析
-
pH相同、体积相同的氨水和氢氧化钠溶液分别采取下列措施,有关叙述正确的是
A.加入适量的氯化铵晶体后,两溶液的pH均碱小
B.温度下降10°C,两溶液的pH均不变
C.分别加水稀释10倍,两溶液的pH仍相等
D.用同浓度的盐酸中和,消耗盐酸的体积相同
难度: 中等查看答案及解析
-
下列可用于测定溶液pH且精确度最高的是( )
A.酸碱指示剂 B.pH计 C.精密pH试纸 D.广泛pH试纸
难度: 简单查看答案及解析
-
支撑海港码头基础的钢管桩,常用外加电流的阴极保护法进行防腐,工作原理如图所示,其中高硅铸铁为惰性辅助电极。下列有关表述不正确的是

A.被保护的钢管桩为阴极,高硅铸铁惰性辅助电极为阳极
B.高硅铸铁的作用是作为损耗阳极材料和传递电流
C.通入的保护电流应该根据环境条件变化进行调整
D.通入的保护电流应使钢管桩表面腐蚀电流接近于零
难度: 中等查看答案及解析
-
图中的原电池可以测定AgCl的沉淀溶解平衡常数。有关该原电池的说法不正确的是
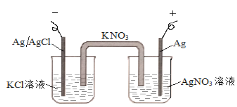
A.负极的电极反应式为:Ag+Cl--e-=AgCl
B.正极的电极反应式是Ag++ e-=Ag
C.电池总反应不是氧化还原反应,不能组成原电池
D.反应时,盐桥中的K+移向AgNO3溶液,NO3-移向KCl溶液
难度: 中等查看答案及解析
-
常温下,将等体积、等物质的量浓度的NH4HCO3与NaCl溶液混合,析出部分NaHCO3晶体,过滤,所得滤液pH<7。下列关于滤液中的离子浓度关系不正确的是
A.c(OH-)<1.0×10-7mol/L
B.c(Na+)= c(HCO3-)+ c(CO32-)+ c(H2CO3)
C.c(Cl-)> c(NH4+)> c(HCO3-)> c(CO32-)
D.c(H+)+c(NH4+)= c(OH-)+ c(HCO3-)+2 c(CO32-)
难度: 困难查看答案及解析
-
低温脱硝技术可用于处理废气中的氮氧化物,发生的化学反应为:2NH3(g)+NO(g)+NO2(g)
2N2(g)+3H2O(g)
H<0。在恒容的密闭容器中,下列有关说法正确的是
A.平衡时,其他条件不变,升高温度可使该反应的平衡常数增大
B.单位时间内消耗NO和N2的物质的量比为1∶2时,反应达到平衡
C.平衡时,其他条件不变,增加NH3的浓度,逆反应速率将减小
D.其他条件不变,使用高效催化剂,废气中氮氧化物的平衡转化率增大
难度: 中等查看答案及解析
-
H2和I2在一定条件下能发生反应:H2(g)+I2(g)
2HI(g)△H=—a kJ/mol,下列说法正确的是( )
已知:
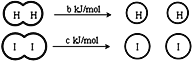 (a、b、c均大于零)
(a、b、c均大于零)A.H2、I2和HI分子中的化学键都是非极性共价键
B.断开2 mol HI分子中的化学键所需能量约为(c+b+a) kJ
C.相同条件下,1 mol H2 (g)和1mol I2 (g)总能量小于2 mol HI (g)的总能量
D.向密闭容器中加入2 mol H2(g)和2 mol I2(g),充分反应后放出的热量为2a kJ
难度: 中等查看答案及解析
-
下列说法正确的是
A.pH=3的盐酸与pH=11的氨水混合,若溶液显中性,则V(盐酸)>V(氨水)
B.室温时某溶液的pH<7,则该物质一定是酸或强酸弱碱盐
C.Na2CO3溶液呈碱性的原因:CO32-+2H2O⇌H2CO3+2OH-
D.0.1 mol∙Lˉ1CH3COOH溶液加水稀释,CH3COO- 数目增多,c(OH-)减少
难度: 困难查看答案及解析
-
某工业流程中,进入反应塔的混合气体中NO和O2的物质的量分数分别为0.10和0.06,发生化学反应2NO(g)+O2(g)⇌2NO2(g),在其他条件相同时,测得实验数据如表:
压强/(×105 Pa)
温度/℃
NO达到所列转化率需要时间/s
50%
90%
98%
1.0
30
12
250
2830
90
25
510
5760
8.0
30
0.2
3.9
36
90
0.6
7.9
74
根据表中数据分析,下列说法正确的是
A.增大压强,反应速率变慢
B.升高温度,反应速率加快
C.在8.0×105 Pa、30℃条件下,当转化率为98%时反应已达平衡
D.若进入反应塔的混合气体为a mol,反应速率以v=Δn/Δt表示,则在8.0×105 Pa、30℃条件下,转化率从50%增至90%时段NO的反应速率为4a/370 mol·s-1
难度: 中等查看答案及解析
-
常温下,分别取浓度不同、体积均为20.00mL的3种HCl溶液,分别滴入浓度为1.000mol·L-1,0.1000mol·L-1和0.01000mol·L-1的NaOH溶液,测得3个反应体系的pH随V(NaOH)的变化的曲线如图,在V(NaOH)=20.00mL前后出现突跃。下列说法不正确的是
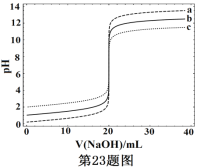
A. 3种HCl溶液的c(HCl):最大的是最小的100倍
B. 曲线a、b、c对应的c(NaOH):a>b>c
C. 当V(NaOH)=20.00mL时,3个体系中均满足:c(Na+)=c(Cl-)
D. 当V(NaOH)相同时,pH突跃最大的体系中的c(H+)最大
难度: 中等查看答案及解析
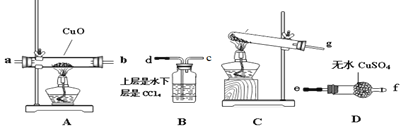
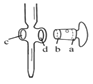 图中,应将凡士林涂在旋塞的a端和旋塞套内的c端
图中,应将凡士林涂在旋塞的a端和旋塞套内的c端