-
用铜锌合金制成假金元宝骗人的事件屡有发生。下列不易区别其真伪的方法是( )
A.观察外观 B.放入硝酸中 C.放入盐酸中 D.测定密度
难度: 简单查看答案及解析
-
向明矾KAl(SO4)2.12H2O溶液里滴入Ba(OH)2溶液, 当SO42-恰好完全沉淀时,其中元素的存在形式为
A.全部形成AlO2-
B.全都为Al(OH)3
C.一部分为Al(OH)3,一部分为Al3+
D.一部分为Al(OH)3,一部分为AlO2-
难度: 简单查看答案及解析
-
在1L 1mo/L氨水中,下列叙述正确的是( )
A.含1molNH3·H2O
B.含NH3、NH4+之和为1mol
C.只含有1molNH3
D.NH3、NH3·H2O、NH4+的物质的量之和为1mol
难度: 简单查看答案及解析
-
溶于水时,下列物质或微粒对水的电离平衡起促进作用的是
A.HCl B.NaHSO4 C.NO3— D.CH3COO—
难度: 中等查看答案及解析
-
下列气体溶于水后,生成物中既有强电解质又有弱电解质的是( )
A.Cl2 B.NH3 C.NO2 D.SO2
难度: 简单查看答案及解析
-
下列说法正确的是
A.活化分子的平均能量称为活化能
B.活化分子互相碰撞即可发生化学反应
C.催化剂是通过增大反应所需的活化能来增大反应速率的
D.升高温度会加快化学反应速率,其原因是增加了活化分子的百分率
难度: 中等查看答案及解析
-
下列事实能用平衡移动原理解释的是
A.在配制硫酸亚铁溶液时往往要加入一定量铁粉
B.光照新制的氯水时,溶液的pH逐渐减小
C.加催化剂,使氮气和氢气在一定条件下转化为氨气
D.工业制氨气常采用500℃左右的较高温度
难度: 中等查看答案及解析
-
向绝热恒容密闭容器中通入SO2和NO2,在一定条件下使反应SO2(g)+NO2(g)
SO3(g)+NO(g) 达到平衡,正反应速率随时间变化的示意图如下所示,由图可得出的正确结论是
A. 反应在c点达到平衡状态
B. △t1=△t2时,SO2的转化率:a~b段小于b~c段
C. 反应物浓度:a点小于b点
D. 反应物的总能量低于生成物的总能量
难度: 中等查看答案及解析
-
在一定温度下的恒容密闭容器中,反应3X(g)
2Y(g)+Z(g)+W(s),ΔH=-QkJ·mol-1,反应已达到平衡的标志是
A. 混合气体的压强不再变化 B. 混合气体的密度不再改变
C. 反应混合物中各组分的浓度相等 D. 两种物质X、Y的反应速率之比为3∶2
难度: 中等查看答案及解析
-
下列物质的水溶液因水解而呈酸性的是
A.NH4Cl B.Na2CO3 C.HCl D.NaOH
难度: 中等查看答案及解析
-
某温度下,等体积等pH的醋酸钠和NaOH两溶液,下列说法正确的是
A.c(NaOH)= c(CH3COONa)
B.两溶液中水的电离程度相同
C.加水稀释相同倍数后,醋酸钠溶液的pH大于NaOH溶液
D.分别与等浓度的盐酸反应至中性,消耗盐酸的体积相同
难度: 中等查看答案及解析
-
10月24日港珠澳大桥正式通车。深埋在海水中的钢管桩易发生腐蚀,但中科院金属所技术能保障大桥120年耐久性。下列保护钢管桩的措施不合理的是( )
A.使用抗腐蚀性强的合金钢
B.在钢筋表面附上新一代高性能环氧涂层
C.钢管桩附着铜以增强抗腐蚀性
D.使用原位腐蚀监测系统设计
难度: 简单查看答案及解析
-
下列说法正确的是
A.1 mol·L-1氯化铁溶液中阳离子数目大于NA
B.25℃与60℃时,水的pH相等
C.中和等体积、等物质的量浓度的盐酸和醋酸所消耗的n ( NaOH)相等
D.2SO2(g)+O2(g) = 2SO3 (g)和4SO2(g)+2O2(g) = 4SO3 (g)的∆H相等
难度: 中等查看答案及解析
-
下列说法不正确的是
A.电能属于一次能源
B.太阳能电池的能量转化方式为光能→电能
C.植物及其加工品所储存的能量为生物质能
D.芒硝晶体(Na2SO4·10H2O)白天在阳光下曝晒后失水、溶解吸热,夜里重新结晶放热,实现太阳能转化为化学能继而转化为热能
难度: 中等查看答案及解析
-
下列表达不正确的是
A.任何化学反应都伴随着能量的变化
B.化学反应中化学键的断裂和形成是反应过程中有能量变化的本质原因
C.氢气燃烧的热化学方程式为:2H2(g)+O2(g) =2H2O(g) ∆H = 571.6kJ·mol-1
D.在化学反应中需要加热的反应不一定是吸热反应
难度: 中等查看答案及解析
-
下列说法中不正确的是
A.铵态氮肥通常不能与碱性肥料(如草木灰K2CO3) 混合施用
B.NO2溶于水生成硝酸,因此NO2是硝酸的酸酐
C.雷雨时,可增加土壤中硝酸盐类氮肥的含量,此变化属于氮的固定
D.氮气常可做焊接金属时的保护气
难度: 中等查看答案及解析
-
下列反应的离子方程式书写不正确的是
A.氢氧化铝的酸式电离:Al(OH)3+H2O⇌[Al(OH)4] —+H+
B.铜与稀硝酸的反应:Cu+4H++NO3—= Cu2+ + NO2+H2O
C.将去膜的铝片投入到NaOH溶液中:2Al+2OH—+6H2O=2[Al(OH)4]—+3H2↑
D.用碘化钾淀粉溶液检验亚硝酸钠中NO2—的存在:2NO2—+2I—+4H+=2NO↑+I2+2H2O
难度: 中等查看答案及解析
-
下列说法正确的是
A.反应物本身的性质是决定反应速率的主要内部因素
B.绿色化学的核心是应用化学原理对环境污染进行治理
C.要使新制氯水里次氯酸的浓度增大,可向其中加入过量的氢氧化钠或碳酸钙
D.MnO2的用量及颗粒大小均不会影响H2O2的分解速率
难度: 中等查看答案及解析
-
下列事实中,能说明HX是弱酸的是
A.0.10 mol·L-1HX溶液能使紫色石蕊试液变红
B.0.10 mol·L-1HX溶液能与鸡蛋壳反应生成CO2气体
C.0.10 mol·L-1NH4Cl呈酸性,0.10 mol·L-1NH4X溶液呈中性
D.0.10 mol·L-1HX溶液中c(H+)= c(Xˉ)+c(OHˉ)
难度: 中等查看答案及解析
-
下列说法正确的是
A.CoCl2·6H2O加热转化为无水CoCl2颜色由蓝色变为粉红色
B.Na2S2O3溶液与稀硫酸反应,可以通过观察气体产生的快慢来确定反应的快慢
C.HNO3—AgNO3溶液不能检验工业盐(NaNO2)和生活盐(NaCl)
D.将两块未擦去氧化膜的铝片分别投入到1mol·L-1CuSO4溶液和1mol·L-1CuCl2溶液中,一段时间后,在CuCl2溶液中铝片表面能观察到明显的反应现象
难度: 中等查看答案及解析
-
某温度下,在一个2 L的密闭容器中加入4 mol A和2 mol B进行如下反应:3A(g)+2B(g)
4C(s)+D(g),反应2 min后达到平衡,测得生成1.6 mol C,下列说法正确的是
A.前2 min,D的平均反应速率为0.2 mol·L-1·min-1 B.此时,B的平衡转化率是40%
C.升高该体系的温度,化学平衡常数不变 D.增加C,逆向速率增大
难度: 中等查看答案及解析
-
最近,科学家研发了“全氢电池”,其工作原理如图所示。下列说法正确的是
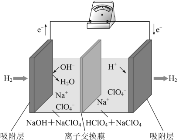
A.右边吸附层中发生了氧化反应
B.负极的电极反应是H2-2e-+2OH-=2H2O
C.当右边吸附层中产生标准状况下氢气2.24L时,电子在溶液中通过了0.2mol.
D.电解质溶液中Na+向左移动,ClO4—向右移动
难度: 中等查看答案及解析
-
下列说法不正确的是
A.铝与氧气反应实验中,将铝条绕成螺旋状的目的是增大反应的接触面积
B.变量控制是研究外部条件对实验产生影响的重要方法
C.亚硝酸钠是一种常用的食品添加剂,可以放心食用
D.明矾大晶体的培养一般需要先加入规则的明矾小晶体作为晶核
难度: 中等查看答案及解析
-
25℃时,浓度均为0.1 mol·Lˉ1的溶液,其pH如表所示,下列有关说法正确的是( )
序号
①
②
③
④
溶液
NaCl
CH3COONH4
NaF
NaHCO3
pH
7.0
7.0
8.1
8.4
A.①和②中溶质均未水解
B.由③④可得出酸性强弱关系:H2CO3>HF
C.③中:c(Na+)+c(H+)=c(Fˉ)+c(OHˉ)
D.④中:c(HCO3ˉ)+2c(CO32ˉ)+c(H2CO3)=0.1mol·Lˉ1
难度: 中等查看答案及解析