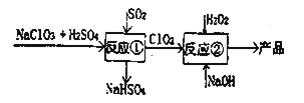
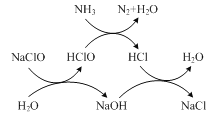
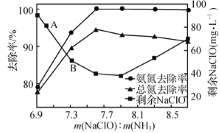
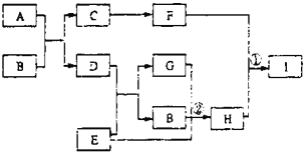
-
下列哪种物质不列入城市“空气质量日报”的首要污染物( )
A.CO2 B.NO2 C.SO2 D.可吸入颗粒物PM2.5
难度: 简单查看答案及解析
-
下列有关化学用语表示正确的是( )
A.纯碱的化学式:NaOH
B.氟原子的结构示意图:
C.光导纤维的主要成分:Si
D.明积[KAl(SO4)2·12H2O]溶于水后的电离方程式:KAl(SO4)2=K++Al3++2SO42-
难度: 简单查看答案及解析
-
下列物质能直接由单质化合得到的是( )
A.FeCl2 B.SO3 C.NO2 D.CuCl2
难度: 简单查看答案及解析
-
下列物质提纯的方法正确的是( )
A.除去混在NO2中的NO:将气体与足量O2混合
B.除去Cl2中的HCl:将混合气体通入装有饱和NaOH溶液的洗气瓶
C.除去KCl溶液中的K2CO3:加入过量BaCl2溶液后过滤
D.除去混在CO2中的SO2:将气体依次通过足量酸性KMO4溶液和浓硫酸
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是( )
A.强碱性溶液中:NH4+、Cl-、Ba2+、Na+
B.新制饱和氯水中:K+、Fe2+、SO32-、SO42-
C.澄清透明的溶液中:MnO4-、NO3-、SO42-、K+
D.c(I-)=0.1mol L-1的溶液中:Na+、Fe3+、ClO-、SO42-
难度: 中等查看答案及解析
-
下表中各项分类都正确的一组是( )
混合物
碱性氧化物
酸性氧化物
电解质
A
水玻璃
Na2O2
CO2
H2O
B
漂白粉
Fe2O3
SiO2
CaCO3
C
液氨
Al2O3
SO2
NaCl
D
铝热剂
Na2O
NO2
NaHCO3
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
关于下列实验装置的说法正确的是( )
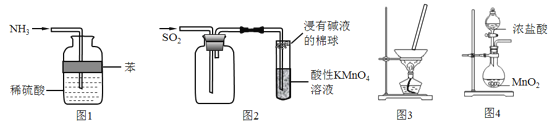
A.用图1吸收多余氨气且防止倒吸 B.用图2收集SO2并验证其还原性
C.图3蒸干NH4Cl饱和溶液制备NH4Cl晶体 D.用图4实验室制取氯气
难度: 中等查看答案及解析
-
下列物质性质与应用对应关系正确的是( )
A.次氯酸有酸性,可用于漂白、杀菌消毒
B.二氧化硫具有漂白性,可用于粉丝、木耳等的漂白
C.液氨汽化时要吸收大量的热,工业上可用作制冷剂
D.晶体硅的熔点高、硬度大,可用于制作半导体材料
难度: 简单查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是( )
A.FeCl2溶液中通入Cl2:Fe2++Cl2=Fe3++2Cl-
B.氯气溶于水:Cl2+H2O
H++CI-+HClO
C.次氯酸钙中通二氧化硫:SO2+Ca2++H2O+2ClO-=CaSO3↓+2HClO
D.水玻璃(硅酸钠水溶液)中滴加醋酸:SiO32-+2H+=H2SiO3↓
难度: 简单查看答案及解析
-
某温度下,将Br2通入NaOH溶液中,反应后得到NaBr、 NaBrO、 NaBrO3的混合溶液,经测定BrO-与Br-离子的物质的量之比是2:7,则Br2与NaOH反应时,氧化剂与还原剂的物质的量之比为( )
A.7:3 B.7:2 C.7:1 D.7:5
难度: 中等查看答案及解析
-
下列有关物质的制备说法正确的是( )
A.将SiO2加入水中,可以获得硅酸胶体
B.加热氯化铵固体,可以制取氨气
C.向沸水中逐滴加入5~6滴FeCl3饱和溶液,继续煮沸至溶液呈红褐色,停止加热,可制得Fe(OH)3胶体
D.向硫酸铝溶液中,加氢氧化钠溶液至过量可以获得Al(OH)3沉淀
难度: 简单查看答案及解析
-
实验室提供的玻璃仪器有试管、导管、容量瓶、烧杯、酒精灯、表面皿、玻璃棒、集气瓶(非玻璃仪器及其他化学用品任选),选用上述仪器能完成的实验是( )
A.粗盐的提纯 B.实验室制氨气 C.用四氯化碳萃取碘水中的碘 D.配制0.1mol·L-1的盐酸溶液
难度: 简单查看答案及解析