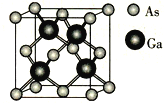
-
中华文明源远流长,在《天工开物》一书中有如下描述:“世间丝、麻、裘、褐皆具素质,而使殊颜异色得以尚焉,谓造物不劳心者,吾不信也。”下列说法正确的是
A.闻名中外的宣纸与描述中“褐”(“褐”指粗布)的主要成分相同
B.描述中“丝、麻”的主要成分均是纤维素
C.丝绸衣服脏了应该选用碱性合成洗涤剂进行洗涤
D.“裘”与人造革的主要成分虽然相同,但可用灼烧方法区别
难度: 中等查看答案及解析
-
去铁酮可用于治疗铁负荷过多的地中海贫血患者。去铁酮的结构简式如图所示,下列关于去铁酮的说法正确的是
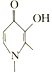
A.可以发生加成反应、酯化反应
B.分子式为C7H10NO2
C.分子中所有原子可能共面
D.不能使酸性高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
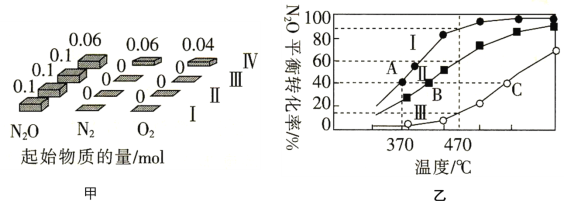
捕获二氧化碳生成甲酸的过程如图所示。下列说法正确的是(NA为阿伏加德罗常数的值)

A.标准状况下,22.4 L CO2中所含的电子数目为16NA
B.10.1 g N(C2H5)3中所含的极性共价键数目为2.1NA
C.2 mol Au与2 mol H2中所含的分子数目均为2NA
D.100 g 46%的甲酸水溶液中所含的氧原子数目为5NA
难度: 中等查看答案及解析
-
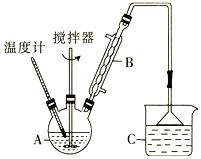
乙醇催化氧化制取乙醛(沸点为20.8℃,能与水混溶)的装置(夹持装置已略)如图所示:
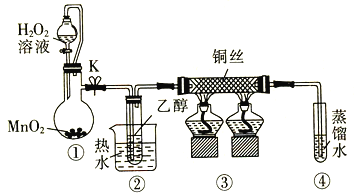
下列说法错误的是
A.向圆底烧瓶中滴入H2O2溶液前需打开K
B.实验开始时需先加热②,再通O2,然后加热③
C.装置③中发生的反应为2CH3CH2OH +O2
2CH3CHO+2H2O
D.实验结束时需先将④中的导管移出。再停止加热
难度: 中等查看答案及解析
-
常温下,将pH和体积均相同的HNO2和CH3COOH溶液分别稀释,其pH随加水体积的变化如图所示。下列叙述正确的是
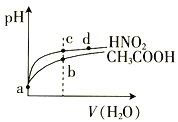
A.电离平衡常数:Ka(CH3COOH)>Ka(HNO2)
B.溶液中水的电离程度:b>c
C.a点时,相同体积的两溶液分别与NaOH恰好中和后,溶液中的n(Na+)相等
D.从c点到d点,溶液中
的值保持小变
难度: 中等查看答案及解析
-
肼(N2H4)碱性燃料电池的原理示意图如图所示,电池总反应为:N2H4+O2=N2+2H2O。下列说法错误的是
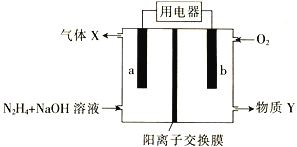
A.电极b发生还原反应
B.电流由电极a流出经用电器流入电极b
C.物质Y是NaOH溶液
D.电极a的电极反应式为N2H4 + 4OH--4e-=N2↑ + 4H2O
难度: 中等查看答案及解析
-
X、Y、Z、W是四种原子序数依次增大的短周期元素,W的最外层电子数为X最外层电子数的一半,X、Y、Z的原子半径依次减小,X、Y、Z组成的一种化合物(ZXY)2的结构式为Y≡X—Z—Z—X≡Y。下列说法正确的是
A.最简单氢化物的稳定件:X>Y
B.Y的氧化物对应的水化物是强酸
C.化合物W3Y2中只含有离子键
D.X和Z组成的化合物中不可能所有原子都达到8电子稳定结构
难度: 中等查看答案及解析
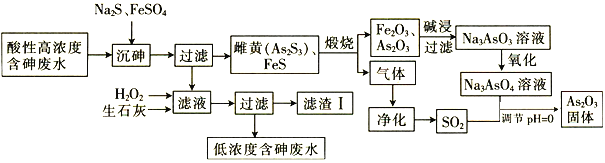

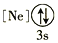 C.[Ne] D.
C.[Ne] D. 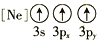
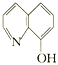 (8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为_______;
(8—羟基喹啉)合成。LiAlH4中阴离子的空间构型为_______;