-
化学与生产、生活、科技、环境等密切相关。下列说法正确的是
A.“华为麒麟980”手机中芯片的主要成分是二氧化硅
B.流感疫苗要冷藏存放,以免蛋白质变性
C.“地沟油”经分馏可得汽油,用作汽车燃料
D.国产大飞机C919使用的“现代工业骨骼”碳纤维是一种新型的有机高分子材料
难度: 简单查看答案及解析
-
我国出土的文物呈现了瑰丽的历史文化。下列文物中,主要成分属于合金的是( )。

A. 西夏佛经纸本 B. 西汉素纱禅衣 C. 唐兽首玛瑙杯 D. 东汉青铜奔马
难度: 中等查看答案及解析
-
《本草纲目》中记载“自元时始创其法,用浓酒和糟入甑,蒸令气上,用器承滴露”,其“法”是指
A.过滤 B.蒸馏 C.萃取 D.结晶
难度: 简单查看答案及解析
-
下列有关化学用语说法不正确的是
A.中子数为7的碳原子:
B.氯乙烯的结构简式:CH2=CHCl
C.羟基的电子式:
D.乙酸分子的比例模型:
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定溶液中能大量共存的是
A.无色透明溶液中:Fe3+、NH4+、Br-、CO32-
B.0.1 mol·L-1 KNO3溶液中:Na+、Fe2+、Cl-、SO42-
C.使甲基橙变红的溶液中:Na+、Mg2+、SO32-、AlO2-
D.水电离产生的c(H+)=10-13 mol·L-1的溶液中:K+、Ca2+、NO3-、HCO3-
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法错误的是
A.1molNa2O2与过量水反应转移电子数为NA
B.18g D2O和18g H2O中含有的质子数均为10NA
C.0.1mol FeCl3水解形成的Fe(OH)3胶体粒子数小于0.1 NA
D.由1mol NH4Cl和少量NH3·H2O形成的中性溶液中,NH4+数目为NA
难度: 中等查看答案及解析
-
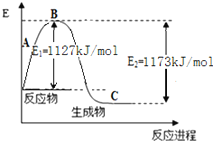
某反应2A=3B,它的反应能量变化曲线如图所示,下列有关叙述正确的是
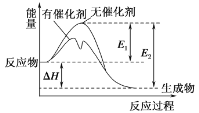
A.该反应为吸热反应
B.A比B更稳定
C.加入催化剂会改变反应的焓变
D.整个反应的ΔH=E1-E2
难度: 中等查看答案及解析
-
除去下列物质中的杂质选用的试剂和方法最合理的是
物质
杂质
试剂
方法
A
固体NaHCO3
固体Na2CO3
/
加热
B
CO2
SO2
酸性KMnO4溶液、浓硫酸
洗气
C
NaCl溶液
NaI
氯水、酒精
萃取、分液
D
Fe2O3
SiO2
盐酸
过滤
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
元素R、X、T、Z、Q在元素周期表中的相对位置如表所示,其中R单质在暗处与H2剧烈化合并发生爆炸。则下列判断正确的是
R
X
T
Z
Q
A.简单离子半径:R<T<X
B.X元素在自然界中只存在化合态
C.气态氢化物的稳定性:R<T<Q
D.最高价氧化物的水化物的酸性:T<X
难度: 简单查看答案及解析
-
下列离子方程式中正确的是
A.用铁电极电解饱和食盐水:2Cl-+2H2O
2OH-+H2↑+Cl2↑
B.Fe(NO3)3溶液中加入过量的HI溶液2Fe3++2I-=2Fe2++I2
C.少量SO2通入Ca(ClO)2溶液中:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
D.向Mg(HCO3)2溶液中加入过量的NaOH溶液:Mg2++2HCO3-+4OH-=Mg(OH)2↓+2CO32-+2H2O
难度: 中等查看答案及解析
-
氮氧化铝(AlON)属于原子晶体,是一种具有良好性能的超强透明材料。可以由反应Al2O3+C+N2
2AlON+CO合成,下列有关说法正确的是
A.氮氧化铝中Al元素的化合价是+3
B.AlON和Al2O3的化学键类型相同
C.反应中每生成5.7g AlON同时生成1.12 L CO
D.反应中氧化产物和还原产物的物质的量之比是2:1
难度: 中等查看答案及解析
-
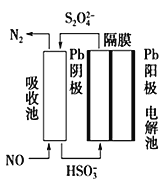
一种用于驱动检验管道焊缝设备爬行器的CH3OH-O2燃料电池的工作原理示意如图,下列有关该电池说法正确的是
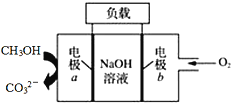
A.标况下,该电池工作时,每消耗22.4L CH3OH转移6 mol电子
B.电子由电极a经负载流向电极b,再经过氢氧化钠溶液返回电极a,形成闭合回路
C.电池工作时,OH-向电极a移动,溶液的pH减小
D.电极b上发生的电极反应为O2+4H++4e-=2H2O
难度: 中等查看答案及解析
-
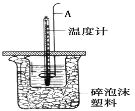
利用下列实验装置能完成相应实验的是
A.
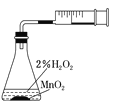 该装置(秒表未画出)测定化学反应速率
该装置(秒表未画出)测定化学反应速率B.
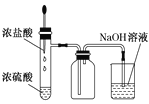 该装置制取HCl并吸收尾气
该装置制取HCl并吸收尾气C.
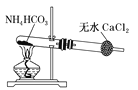 该装置制备纯净的NH3
该装置制备纯净的NH3D.
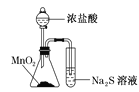 该装置比较MnO2、Cl2、S的氧化性
该装置比较MnO2、Cl2、S的氧化性难度: 中等查看答案及解析
-
在可逆反应m A(s)+n B(g)⇌e C(g)+fD(g)过程中,当其他条件不变时,C的百分含量(用φ(C)表示)在不同温度(T)和不同压强(P)的条件下随时间(t)的变化关系如图所示。下列叙述正确的是
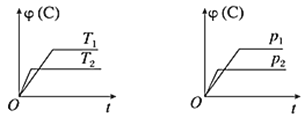
A.化学方程式中,n>e+f
B.反应达到平衡后,若使用催化剂,C的百分含量将增大
C.反应达到平衡后,若温度升高,化学平衡向逆反应方向移动
D.反应达到平衡后,增加A的质量有利于化学平衡向正反应方向移动
难度: 中等查看答案及解析
-
下列有关实验操作、现象、解释或结论都正确的是
选项
实验操作
现象
解释或结论
A
将Na2CO3溶液由0.1 mol·L-1稀释到0.01 mol·L-1,测溶液pH
溶液pH变小
稀释后CO32-的水解程度减小
B
将NaAlO2与AlCl3溶液混合
出现白色沉淀
AlO2-与Al3+发生相互促进的水解反应
C
将盛有红棕色NO2气体的注射器由10 mL压缩至5 mI
气体颜色比压缩前浅
反应2NO2⇌N2O4向右移动
D
向湿润的有色布条中通入氯气
布条褪色
氯气具有漂白性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
有机物X、Y的转化关系如下,下列说法正确的是
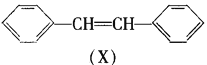
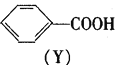
A.Y属于芳香烃
B.X转化为Y的反应属于取代反应
C.X能使Br2的CCl4溶液褪色
D.Y分子苯环上的一氯代物有5种
难度: 中等查看答案及解析
-
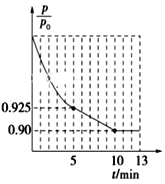
室温下,用0.1 mol·L-1的NaOH溶液滴定10.00mL 0.1 mol·L-1的CH3COOH溶液,水的电离程度随滴入NaOH溶液体积的变化曲线如图所示:
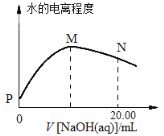
下列说法正确的是
A.该滴定过程应该选择甲基橙作为指示剂
B.从P点到N点,溶液中水的电离程度逐渐增大
C.N点溶液中c(Na+)=c(CH3COO-)+c(OH-)
D.M点对应的NaOH溶液的体积为10.00mL
难度: 中等查看答案及解析
-
钼酸钠(Na2MoO4)是一种新型阻燃剂和水处理剂。从一种含钼的废弃催化剂(主要成分为MoO3、Al2O3、Fe2O3等)中可回收Na2MoO4,其工艺流程如下:
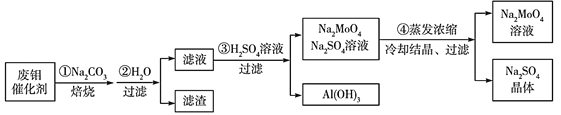
已知:MoO3、Al2O3与SiO2相似,均能在高温下与Na2CO3发生类似反应。下列有关叙述错误的是
A.焙烧时发生反应之一:Al2O3+Na2CO3=2NaAlO2+CO2↑
B.用硫酸浸取②操作后所得滤渣,向其中加入KSCN溶液,溶液变为血红色
C.步骤③中硫酸溶液需加过量
D.由步骤④可知Na2MoO4溶解度随温度变化较小
难度: 中等查看答案及解析