-
有五个系列同族元素的物质,101.3 kPa时测定它们的沸点(℃)如下表所示:
①
He -268.8
(a) -249.5
Ar -185.8
Kr 151.7
②
F2 -187.0
Cl2 -33.6
(b) 58.7
I2 184.0
③
(c) 19.4
HCl -84.0
HBr -67.0
HI -35.3
④
H2O 100.0
H2S -60.0
(d) -42.0
H2Te -1.8
⑤
CH4 -161.0
SiH4 -112.0
GeH4 -90.0
(e) -52.0
对应表中内容,下列叙述中正确的是( )
A. a、b、c代表的化学物中均含化学键
B. 系列②物质均有氧化性;系列③物质对应水溶液均是强酸
C. 系列④中各化合物的稳定性顺序为:H2O>H2S>H2Se>H2Te
D. 上表中物质HF和H2O,由于氢键的影响,其分子特别稳定
难度: 中等查看答案及解析
-
X、Y、Z、W、R是5种短周期元素,其原子序数依次增大。X是周期表中原子半径最小的元素,Y原子最外层电子数是次外层电子数的3倍,Z、W、R处于同一周期,R与Y处于同一族,Z、W原子的核外电子数之和与Y、R原子的核外电子数之和相等。下列说法正确的是( )
A.元素Y、Z、W具有相同电子层结构的离子,其半径依次增大
B.元素X不能与元素Y形成化合物X2Y2
C.元素Y、R分别与元素X形成的化合物的热稳定性:XmY>XmR
D.元素W、R的最高价氧化物的水化物都是强酸
难度: 中等查看答案及解析
-
一般情况下,前者无法决定后者的是
A.原子核外电子排布﹣﹣元素在周期表中的位置
B.硝酸具有强氧化性﹣﹣铜单质易溶于浓硝酸
C.分子间作用力的大小﹣﹣分子稳定性的高低
D.二氧化硫具有还原性﹣﹣二氧化硫能使高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
下列化学用语书写正确的是
A.氯离子的结构示意图:
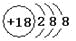
B.作为相对原子质量测定标准的碳核素:
C
C.氯化镁的电子式:
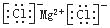
D.用电子式表示氯化氢分子的形成过程:

难度: 中等查看答案及解析
-
下列有关元素及其化合物性质的比较正确的是( )
A.原子半径:F<O<Al B.稳定性:H2O<PH3<NH3
C.酸性:H2CO3<H2SO4<H3PO4 D.碱性:LiOH<NaOH<Al(OH)3
难度: 中等查看答案及解析
-
科学家最近研究出一种环保、安全的储氢方法,其原理可表示为:NaHCO3+H2
HCOONa+H2O下列有关说法正确的是( )
A.储氢、释氢过程均无能量变化
B.释氢过程中,每消耗0.1molH2O放出2.24L的H2
C.上述储氢原理和钢瓶储氢原理相同
D.NaHCO3含有离子键和共价键
难度: 中等查看答案及解析
-
下列是四种烷烃分子的球棍模型或结构简式,其中沸点最高的是( )
A.
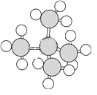 B. CH3CH2CH2CH2CH2CH3 C. CH3CH2CH2CH2CH3 D. CH3CH2CH3
B. CH3CH2CH2CH2CH2CH3 C. CH3CH2CH2CH2CH3 D. CH3CH2CH3难度: 简单查看答案及解析
-
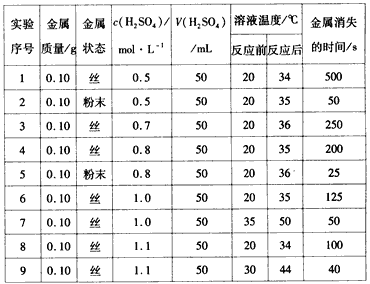
有a、b、c、d四个金属电极,有关的反应装置及部分反应现象如下:
实验装置
部分实验现象
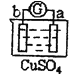
a极质量减小,b极质量增加
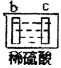
b极有气体产生,c极无变化
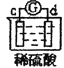
d极溶解,c极有气体产生
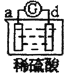
电流计指示在导线中电流从a极流向d极
由此可判断这四种金属的活动性顺序是( )
A.a>b>c>d B.b>c>d>a C.d>a>b>c D.a>b>d>c
难度: 中等查看答案及解析
-
甲~庚等元素在周期表中的相对位置如下表,己的最高价氧化物对应水化物有强脱水性,甲和丁在同一周期,甲原子最外层与最内层具有相同电子数。下列判断正确的是( )
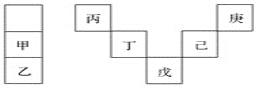
A. 丙与戊的原子序数相差25
B. 气态氢化物的稳定性:庚<己<戊
C. 常温下,甲和乙的单质能与水剧烈反应
D. 丁的最高价氧化物可用于制造光导纤维
难度: 中等查看答案及解析
-
某锂电池的电池总反应为4Li+2SOCl2=4LiCl+S+SO2↑,下列有关说法正确的是( )
A.锂电极作电池负极,放电过程中发生还原反应
B.1 mol SOCl2发生电极反应转移的电子物质的量为4 mol
C.组装该电池必须在无水、无氧的条件下进行
D.电池的正极反应为2SOCl2+2e-=4Cl-+S+SO2 ↑
难度: 中等查看答案及解析
-
下列图示变化为吸热反应的是( )
A.
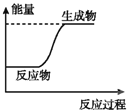 B.
B. 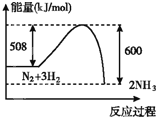
C.
 D.
D. 
难度: 中等查看答案及解析
-
根据元素周期律,由下列事实进行归纳推测,推测不合理的是( )
选项
事实
推测
A.
Na与冷水反应剧烈,K与冷水反应更剧烈
Li与冷水反应缓慢
B.
20Ca(OH)2碱性强于12Mg(OH)2
38Sr(OH)2碱性强于
20Ca(OH)2
C.
Si是半导体材料,同主族的Ge也是半导体材料
第ⅣA元素形成的单质都是半导体材料
D.
F2与H2在暗处剧烈化合,Cl2与H2光照或点燃时反应
Br2与H2反应需要加热到一定温度
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
肼(N2H4)是火箭常用的高能燃料,常温下为液体,其球棍模型如图所示。肼能与双氧水发生反应N2H4+2H2O2=N2+4H2O,用NA表示阿伏加德罗常数的值。下列说法正确的是
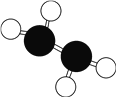
A.标准状况下,11.2 L N2中含有的电子总数为5NA
B.标准状况下,22.4 L N2H4中含有的原子总数为6NA
C.标准状况下,3.2 g N2H4中含有共价键的总数为0.6NA
D.若生成3.6 g H2O,则上述反应转移电子的数目为0.2NA
难度: 中等查看答案及解析
-
在一定温度下,某容积可变的密闭容器中,建立下列化学平衡:C(s)+H2O(g)
CO(g)+H2(g)。下列叙述中不能说明上述可逆反应已达到化学平衡状态的是 ( )
A.体系的压强不再发生变化
B.v正(CO)=v逆(H2O)
C.生成n mol CO的同时生成n mol H2
D.1 mol H—H键断裂的同时断裂2 mol H—O键
难度: 简单查看答案及解析
-
有两种气态烷烃的混合物,在标准状况下,其密度为1.16 g·L-1,则关于此混合物组成的说法正确的是( )
A.一定有甲烷 B.一定有乙烷
C.可能是甲烷和己烷的混合物 D.可能是乙烷和丙烷的混合物
难度: 简单查看答案及解析
-
如图为氢氧燃料电池原理示意图,按照此图的提示,下列叙述不正确的是( )
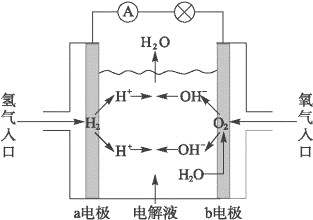
A.a电极是负极
B.b电极的电极反应为:4OH--4e-====2H2O+O2↑
C.氢氧燃料电池是一种具有应用前景的绿色电源
D.氢氧燃料电池是一种不需要将还原剂和氧化剂全部储藏在电池内的新型发电装置
难度: 中等查看答案及解析
-
对于反应4NH3+5O2=4NO+6H2O,下列为4种不同情况下测得的反应速率中,表明该反应进行最快的是
A.v(NH3)=0.2 mol/(L·s) B.v(O2)=1.4 mol/(L·min)
C.v(H2O)=0.25 mol/(L·s) D.v(NO)=9 mol/(L·min)
难度: 简单查看答案及解析
-
将4 mol A气体和1mol B气体在2 L的容器内混合,在一定条件下发生反应: 2A(g) +B(g)
3C(g),若2 min后测得C的浓度为0.6 mol·L-1,则下列说法正确的是
A.用物质A表示反应的平均速率为v(A)= 0.4 mol·(L·min)-1
B.2 min时A、B、C三种气体的总量为5mol
C.2 min时B的转化率为20%
D.若2 min后该反应达平衡,则各种气体的量不再变化,反应停止
难度: 简单查看答案及解析
-
二氯化二硫(S2Cl2)是广泛用于橡胶工业的硫化剂,其分子结构如右下图所示。常温下,S2Cl2遇水易水解,并产生能使品红褪色的气体。下列说法错误的是
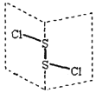
A.S2Cl2的电子式为
B.S2Cl2同时含有极性键和非极性键
C.S2Br2与S2Cl2结构相似,熔沸点:S2Br2 > S2Cl2
D.S2Cl2与H2O反应的化学方程式可能为: 2S2Cl2+2H2O = SO2↑+3S↓+4HCl
难度: 困难查看答案及解析
-
在密闭容器中进行反应:X2(g)+3Y2(g)
2Z(g),其中X2、Y2、Z的起始浓度分别为0.1 mol·L-1、0.3 mol·L-1、0.2 mol·L-1,在一定条件下,当反应达到平衡时,各物质的浓度有可能是( )。
A.c(Z)=0.5 mol·L-1 B.c(Y2)=0.5 mol·L-1
C.c(X2)=0.2 mol·L-1 D.c(Y2)=0.6 mol·L-1
难度: 中等查看答案及解析
 ,该元素在元素周期表中的位置为_______________。
,该元素在元素周期表中的位置为_______________。