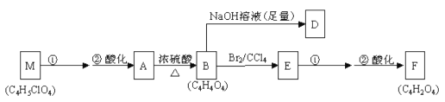
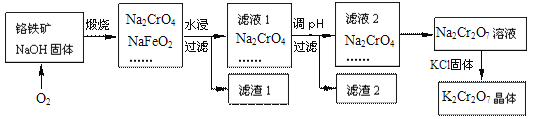
-
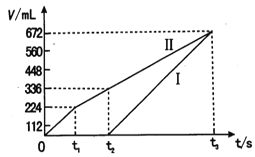
25℃时,把0.2mol/L的醋酸加水稀释,那么图中的纵坐标y表示的是( )
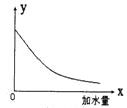
A.溶液中OH-的物质的量浓度 B.溶液的导电能力
C.溶液中的
D.醋酸的电离程度
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值。以下表达正确的选项是( )
A.在标况下,11.2LNO与11.2LO2混合后所含分子数为0.75NA
B.12g金刚石中含有的共价键数为4NA
C.0.1molNa2O2晶体中含有0.3NA个离子
D.铝跟氢氧化钠溶液反应生成1mol氢气时,转移的电子数为NA
难度: 中等查看答案及解析
-
CS2(二硫化碳)是无色液体,沸点46.5℃。储存时,在容器内可用水封盖表面。储存于阴凉、通风的库房,远离火种、热源,库温不宜超过30℃。CS2属于有机物,但必须与胺类分开存放,要远离氧化剂、碱金属、食用化学品,切忌混储。采纳防爆型照明、通风设施。在工业上最重要的用途是作溶剂制造粘胶纤维。以下说法正确的选项是( )
①属易燃易爆的危险品;②有毒,易水解;③是良好的有机溶剂;④与钠反应的产物中一定有Na2CO3;⑤有还原性。
A.①③⑤ B.②③ C.①④⑤ D.②⑤
难度: 简单查看答案及解析
-
以下相关实验不能达到预期目的的是( )
A.试样加水溶解后,再加入足量Ca(OH)2溶液,有白色沉淀生成检验NaHCO3固体中是否含Na2CO3
B.向少量燃尽火柴头的浸泡液中滴加足量稀HNO3、AgNO3验证火柴头含有氯离子
C.加入饱和Na2CO3溶液,充分振荡,静置、分层后,分液除去乙酸乙酯中的乙酸
D.两支试管中装有等体积、等浓度的H2O2溶液,向其中一支试管中加入FeCl3溶液探究FeCl3溶液对H2O2分解速率的影响
难度: 中等查看答案及解析
-
某种兴奋剂的结构如图所示,下列说法正确的是( )
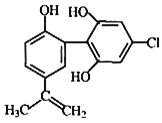
A.该物质遇FeCl3溶液显紫色,属于苯酚的同系物
B.1mol该物质分别与浓溴水和NaOH溶液反应时最多消耗Br2和NaOH均为4mol
C.滴入酸性KMnO4溶液振荡,紫色褪去即证明该物质结构中存在碳碳双键
D.该分子中所有碳原子均可能位于同一平面
难度: 中等查看答案及解析
-
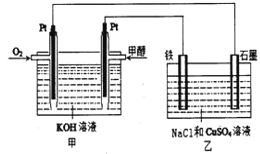
下列叙述正确的是( )
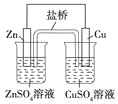
A.电镀时,通常把待镀的金属制品作阳极
B.氯碱工业上电解的是熔融的NaCl
C.氢氧燃料电池(酸性电解质)中O2通入正极,电极反应为O2+4H++4e-=2H2O
D.上图中电子由Zn极移向Cu极,盐桥中的Cl-移向CuSO4溶液
难度: 中等查看答案及解析
-
用NA表示阿伏加德罗常数的值,以下说法正确的选项是( )
①1mol氯气发生反应转移电子数为2NA
②12.0g熔融的NaHSO4中含有的阳离子数为1NA
③在标准状况下,22.4LH2O中的O原子数为NA
④17g羟基中含有的电子数为10NA
⑤1molNa2O和Na2O2混合物中含有的阴、阳离子总数是3NA
⑥20mL1mol/LFe2(SO4)3溶液中,Fe3+和SO42-离子数的总和小于NA
A.①②⑤ B.①④⑥ C.①②⑥ D.②⑤⑥
难度: 中等查看答案及解析