-
已知H+(aq)+OH-(aq)===H2O(l) ΔH=-57.3 kJ·mol-1。现有以下四个化学反应方程式:
①H2SO4(aq)+2NaOH(aq)===Na2SO4(aq)+2H2O(l)
②H2SO4(aq)+Ba(OH)2(aq)===BaSO4(s)+2H2O(l)
③HCl(aq)+NH3·H2O(aq)===NH4Cl(aq)+H2O(l)
④CH3COOH(aq)+NH3·H2O(aq)===CH3COONH4(aq)+H2O(l)
其中放出的热量为57.3 kJ的是
A. ①和② B. ③ C. ④ D. 以上都不对
难度: 中等查看答案及解析
-
常温下将NaOH稀溶液与CH3COOH稀溶液混合,不可能出现的结果是( )
A.pH<7,且c(CH3COO-)>c(H+)>c(Na+)>c(OH-)
B.pH>7,且c(Na+)>c(OH-)>c(H+)>c(CH3COO-)
C.pH>7,且c(Na+)+c(H+)=c(OH-)+c(CH3COO-)
D.pH=7,且c(CH3COO-)=c(Na+)>c(H+)=c(OH-)
难度: 中等查看答案及解析
-
为减少汽车对城市大气的污染,近年来中国成功地开发出了以新燃料作能源的“绿色汽车”。这种汽车可避免有毒的有机铅、苯和苯的同系物以及多环芳烃的排放,保护环境。这种“绿色汽车”的燃料是( )
A.重油 B.汽油 C.柴油 D.甲醇
难度: 中等查看答案及解析
-
关于乙醛的下列反应中,乙醛被还原的是 ( )
A.乙醛的银镜反应 B.乙醛制乙醇
C.乙醛与新制氢氧化铜的反应 D.乙醛的燃烧反应
难度: 简单查看答案及解析
-
可以用来鉴别气态烷烃和烯烃,又可以用来除去烷烃中混有的少量烯烃的操作方法是( )
A.混合气通过盛CCl4的洗气瓶 B.混合气跟氯气混合
C.混合气通过盛水的洗气瓶 D.混合气通过盛足量溴水的洗气瓶
难度: 简单查看答案及解析
-
日常生活中常用到化学知识,下列说法不正确的是( )
A.白色污染、绿色食品中的“白”、“绿”均指相关物质的颜色
B.用食醋可以除去热水壶中的水垢
C.聚氯乙烯塑料有毒,不可用于制食品包装袋
D.新制的Cu(OH)2可以检测糖尿病患者尿液中是否含有葡萄糖
难度: 简单查看答案及解析
-
下列实验过程中,不需要加热的是( )
A.由苯制取硝基苯 B.由苯制取溴苯
C.酚醛树脂的制备 D.由乙醇制取乙烯
难度: 简单查看答案及解析
-
用石墨作电极,电解2 mol·L-1CuSO4溶液时,下列变化不可能发生的是( )
A.阳极附近H+浓度增大 B.阴极质量增加
C.阴极上放出氧气 D.溶液蓝色变浅
难度: 中等查看答案及解析
-
下列属于微溶物质的是( )
A.AgCl B.BaCl2 C.CaSO4 D.Ag2S
难度: 简单查看答案及解析
-
某温度下,在2L的密闭容器中,加入1molX(g)和2molY(g)发生反应:X(g)+m Y(g)
3Z(g),平衡时,X、Y、Z的体积分数分别为30%、60%、10%。在此平衡体系中加入1molZ(g),再次达到平衡后,X、Y、Z的体积分数不变。下列叙述不正确的是
A.m=2
B.两次平衡的平衡常数相同
C.X与Y的平衡转化率之比为1:1
D.第二次平衡时,Z的浓度为0.4 mol·L-1
难度: 困难查看答案及解析
-
在25 ℃时,水的离子积Kw=1.0×10-14,在35 ℃时,水的离子积Kw=2.1×10-14,则下列叙述正确的是( )
A.c(H+)随着温度的升高而降低 B.35 ℃时,c(H+)<c(OH-)
C.35 ℃时的水比25 ℃时的水电离程度小 D.水的电离是吸热的
难度: 简单查看答案及解析
-
已知25 ℃时,AgI饱和溶液中c(Ag+)为1.23×10-8mol·L-1,AgCl的饱和溶液中c(Ag+)为1.25×10-5mol·L-1。若在5 mL含有KCl和KI各为0.01 mol·L-1的溶液中,加入8 mL 0.01 mol·L-1AgNO3溶液,下列叙述正确的是( )
A.混合溶液中c(K+)>c(NO3-)>c(Ag+)>c(Cl-)>c(I-)
B.混合溶液中c(K+)>c(NO3-)>c(Cl-)>c(Ag+)>c(I-)
C.加入AgNO3溶液时首先生成AgCl沉淀
D.混合溶液中
约为1.02×10-3
难度: 困难查看答案及解析
-
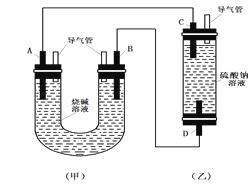
有关如下图所示原电池的叙述,正确的是(盐桥中装有含KCl饱和溶液的琼脂)( )
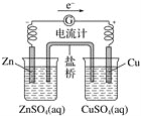
A.反应中,盐桥中的K+会移向CuSO4溶液
B.取出盐桥后,电流计依然发生偏转
C.铜片上有气泡逸出
D.反应前后铜片质量不改变
难度: 简单查看答案及解析
-
某二元弱酸H2A溶液,按下式发生电离:H2A
H++HA-、HA-
H++A2-,下列四种溶液中c(A2-)最大的是( )
A.0.01 mol·L-1的H2A溶液
B.0.01 mol·L-1的NaHA溶液
C.0.02 mol·L-1的盐酸与0.04 mol·L-1的NaHA溶液等体积混合液
D.0.02 mol·L-1的NaOH与0.02 mol·L-1的NaHA溶液等体积混合液
难度: 困难查看答案及解析
-
已知石墨、金刚石燃烧的热化学方程式分别为
①C(石墨,s)+O2(g)=CO2(g) ΔH=-393.5 kJ·mol-1
②C(金刚石,s)+O2(g)=CO2(g) ΔH=-395.4 kJ·mol-1
关于金刚石和石墨的相互转化,下列说法正确的是( )
A.石墨转化成金刚石是自发的过程 B.金刚石转化成石墨是自发的过程
C.石墨比金刚石能量高 D.金刚石比石墨稳定
难度: 简单查看答案及解析
-
25 ℃时纯水的电离度为a1,pH=2的醋酸溶液的电离度为a2,pH=12的氢氧化钠溶液中水的电离度为a3。若将上述醋酸与氢氧化钠溶液等体积混合,所得溶液中水的电离度为a1。下列关系式中正确的是( )
A. a2=a3<a4<a1 B. a3=a2<a1<a4
C. a2<a3<a1<a4 D. a1<a2<a3<a4
难度: 困难查看答案及解析
-
恒温、恒容的条件下对于N2(g)+3H2(g)
2NH3(g) ΔH<0的反应,达到化学平衡状态的标志为
A.断开一个N≡N键的同时有6个N—H键生成
B.混合气体的密度不变
C.混合气体的平均相对分子质量不变
D.N2、H2、NH3分子数之比为1∶3∶2的状态
难度: 简单查看答案及解析
-
常温下,0.1 mol·L-1Na2S溶液中存在着水解平衡:S2-+H2O
HS-+OH-。下列说法正确的是( )
A.加水稀释后恢复至常温,水解平衡正向移动,水解平衡常数增大
B.通入NH3,平衡正向移动
C.滴加少量AgNO3溶液,平衡逆向移动
D.升高温度,c(HS-)/c(S2-)减小
难度: 简单查看答案及解析
-
下列说法正确的是( )
A.生铁的含碳量比钢低
B.油脂的硬化属于化学变化
C.普通玻璃在加热熔化时有固定的熔点
D.向蛋白质溶液中滴加饱和硫酸钠溶液后,蛋白质会发生变性
难度: 简单查看答案及解析
-
下列物质一定属于苯的同系物的是( )
A.
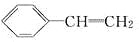 B.
B.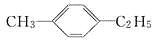
C.
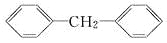 D.
D.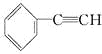
难度: 简单查看答案及解析
-
下列不属于碳原子成键特点的是( )
A.易失去最外层的电子形成离子
B.最外层电子易与其他原子的外层电子形成共用电子对
C.能够形成单键.双键和三键等多种成键形式
D.每个碳原子最多与其他原子形成4个共价键
难度: 简单查看答案及解析
-
两种气态烃组成的混合气体0.1 mol,完全燃烧得 0.16 mol CO2和3.6 g H2O,下列说法正确的是
A.混合气体一定是CH4和C2H4
B.混合气体中一定有CH4,可能含有C2H4
C.混合气体中一定含有CH4,可能含有C2H6
D.混合气体中可能含有C2H2
难度: 中等查看答案及解析
-
某同学做乙醛的性质实验时,取1mol/L的CuSO4溶液和0.5mol/L的NaOH溶液各1mL,在一支洁净的试管内混合后,向其中又加入0.5mL 40%的乙醛,加热煮沸,结果未出现砖红色沉淀。实验失败的原因可能是 ( )
A.反应温度不够高 B.加入NaOH溶液的量不够
C.加入乙醛太多 D.加入CuSO4溶液的量不够
难度: 简单查看答案及解析
-
已知:含C=C的物质(烯烃)一定条件下能与水发生加成反应,生成醇(含羟基的烃的衍生物);有机物A-D间存在图示的转化关系。下列说法不正确的是
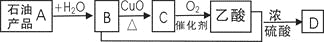
A.D结构简式为CH3COOCH2CH3 B.A能使酸性高锰酸钾溶液褪色
C.B与乙酸发生了取代反应 D.可用B萃取碘水中的碘单质
难度: 简单查看答案及解析
-
化合物丙可由如下反应得到:
C4H10O
C4H8
C4H8Br2
甲 乙 丙
丙的结构简式不可能是( )
A.CH3CH(CH2Br)2 B.(CH3)2C Br CH2Br
C.C2H5CH Br CH2Br D.CH3(CH Br)2CH3
难度: 中等查看答案及解析
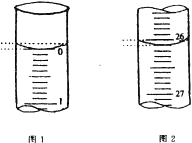
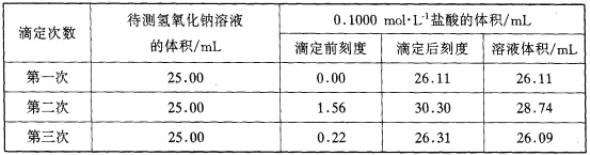
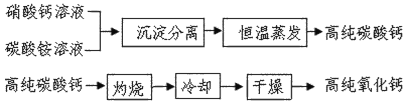
 、
、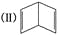 .
.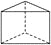 ,该结构的二氯代物有________种.
,该结构的二氯代物有________种.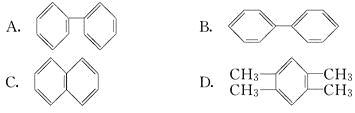
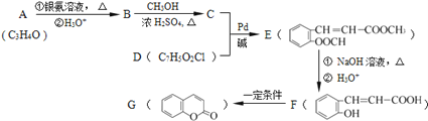
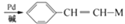 +HX(X为卤原子,M为烃基或含酯基的取代基等).由有机物A合成G(香豆素)的路线如下:
+HX(X为卤原子,M为烃基或含酯基的取代基等).由有机物A合成G(香豆素)的路线如下: