-
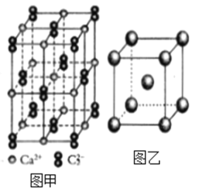
X、Y、Z、M、G五种短周期元素,原子序数依次增大。X、Z同主族,可形成离子化合物ZX;Y、M同主族,可形成MY2、MY3两种分子;Y、G的单质或两元素之间形成的化合物可作水消毒剂。下列叙述正确的是( )
A.元素M的氧化物对应的水化物酸性比G的氧化物对应的水化物酸性弱
B.ZX与水的反应属于氧化还原反应
C.化合物Z2M、MY2中化学键的类型相同
D.简单离子半径的大小顺序:X<Y<Z<M<G
难度: 中等查看答案及解析
-
下列实验操作规范且能达到目的的是( )
选项
目的
操作
A
配制0.010 mol/L的KMnO4溶液
称取KMnO4固体0.158 g,放入100 mL容量瓶中,加水溶解并稀释至刻度
B
除去乙酸乙酯中混有的乙醇
加入适量的乙酸,加热
C
检验乙醇中氢的活泼性
将金属钠投入到盛有医用酒精的烧杯中
D
制备Fe(OH)3胶体
向25 mL沸腾的蒸馏水中逐滴加入6滴饱和FeCl3溶液,继续煮沸至溶液呈红褐色
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
化学与日常生活密切相关。下列说法正确的是
A. 氨气易液化,液氨常用作制冷剂
B. 二氧化硫是一种常见的漂白剂,常用于加工食品使食品增白
C. 燃料电池是一种高效、环境友好的发电装置,其能量转化率可达100%
D. 常温下,铁与浓硫酸不反应,常用铁质容器盛放浓硫酸
难度: 中等查看答案及解析
-
下列说法不正确的是
A.无机物与有机物之间不可能存在同分异构现象
B.乙烯能使溴水、酸性KMnO4溶液褪色,其反应原理不相同
C.福尔马林能使蛋白质发生变性,可用浸制动物标本
D.分子式为C4H10O的有机物与金属Na反应的同分异构体有4种
难度: 简单查看答案及解析
-
下列事实能用勒夏特列原理解释的是
A.工业上N2与H2合成NH3,往往需要使用催化剂
B.向1.50mol/L的硝酸铵溶液中加入少量氨水至中性,水的电离程度减小
C.密闭容器中2molCO与1molH2O(g)充分反应达平衡后,增大压强CO的反应速率加快
D.SO2与O2催化氧化成SO3是一个放热过程,450℃左右的温度比室温更有利于SO3生成
难度: 简单查看答案及解析
-
室温时,向100mL0.1mol/LNH4HSO4溶液中逐滴滴加0.1mol/LNaOH溶液,得到溶液pH与NaOH溶液体积的关系曲线如图所示(假设溶液的体积有加和性)。下列分析正确的是
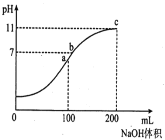
A.ab段和bc段发生的离子反应一定不同
B.水的电离程度最大的是c点
C.b点溶液中各离子浓度由大到小的排列顺序是:C(Na+)>C(NH4+)>C(SO42-)>C(H+)=C(OH-)
D.NH4+的水解平衡常数Kh的数量级为10-10
难度: 中等查看答案及解析
-
一种新型微生物燃料电池可用于污水净化、海水淡化,其工作原理如图所示。下列说法正确的是

A. a为电池的正极
B. 海水淡化的原理是:电池工作时,Na+移向左室,C1-移向右室
C. 处理NO的电极反应为:2 NO+6H2O+10e-===N2↑+12OH-
D. 若用C6H12O6表示有机废水中有机物,每消耗1 mol C6H12O6转移6 mol e-
难度: 中等查看答案及解析
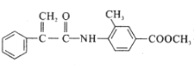 )是一种可用于治疗肿瘤的药物,其合成路线如图所示:
)是一种可用于治疗肿瘤的药物,其合成路线如图所示:
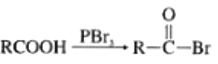 (R为烃基)
(R为烃基) +HBr
+HBr