-
为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺。工艺流程如图:
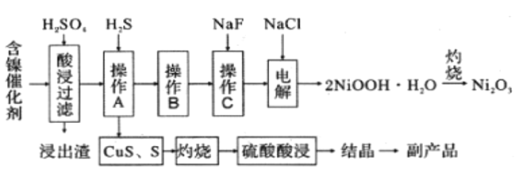
已知:①常温下,有关氢氧化物开始沉淀和沉淀完全的pH如表
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
②常温下,Ksp(CaF2)= 2.7×10-11
回答下列问题:
(1)加快酸浸速率的常用措施有_____________(任写一条)。
(2)写出酸浸时Fe2O3和硫酸反应的离子方程式________________________________。
(3)浸出渣主要成分为CaSO4·2H2O和______________两种物质。
(4)操作B的过程是先在40~50℃加入H2O2,其作用是___________________________(用离子方程式表示);再调节PH至3.7~7.7,操作B可除去溶液中的______元素(填元素名称)。
(5)操作C可除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol/L,则溶液中c(Ca2+):c(F-) =___________________。
(6)在碱性条件下,电解产生2NiOOH·H2O的原理分两步:
① Cl- 在阳极被氧化为ClO-,则阳极的电极反应为_____________________。
② Ni2+ 被ClO-氧化产生2NiOOH·H2O沉淀,则该步反应的离子方程式为______________。
-
为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺。工艺流程如图所示:
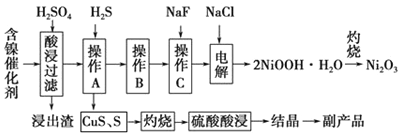
已知:①常温下,有关氢氧化物开始沉淀和沉淀完全的pH如下表所示:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
②常温下,Ksp(CaF2)=2.7×10-11。请回答下列问题:
(1)加快酸浸速率的常用措施有______________(任写一条即可得分)。
(2)“浸出渣”主要成分为CaSO4·2H2O和______两种物质。
(3)“操作B”的过程是,先在40~50℃加入H2O2,其作用是_______________(用离子方程式表示);再调pH至3.7~7.7,操作B可除去溶液中的____(填元素名称)元素。
(4)操作C可除去溶液中的Ca2+,若控制溶液中F-,浓度为3.0×10-3mol·L-1,则溶液中 ____。
____。
(5)在碱性条件下,电解产生2NiOOH·H2O的原理分两步:
①Cl-在阳极被氧化为ClO-,则阳极的电极反应为____________。
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀,则该步反应的离子方程式为______________________。
-
为回收利用含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺。工艺流程如图:
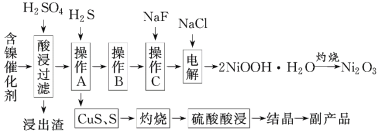
已知:①常温下有关氢氧化物开始沉淀和沉淀完全时的pH如下表所示:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
②Cu2O+2H+=Cu+Cu2++H2O
③常温时,Ksp(CaF2)=2.7×10-11
回答下列问题:
(1)写出酸浸时Fe2O3和硫酸反应的化学方程式:__。
(2)浸出渣主要成分为CaSO4·2H2O和__两种物质。
(3)操作B是除去滤液中的铁元素,某同学设计了如下方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH在3.7~7.7范围内,静置,过滤。请对该实验操作进行评价并说明理由:__(若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)流程中的“副产品”为__(填化学式)。在空气中灼烧CuS可以得到铜的氧化物,向Cu、Cu2O、CuO组成的混合物中加入1L0.6mol·L-1HNO3溶液恰好使混合物溶解,同时收集到2240mLNO气体(标准状况下),若该混合物中含0.1molCu,与稀硫酸充分反应至少消耗__molH2SO4。
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol·L-1,则溶液中 =__。
=__。
(6)电解产生2NiOOH·H2O的原理分两步:
①碱性条件下,Cl-在阳极被氧化为ClO-。生产1molClO-,消耗OH-__mol。
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀,则该步反应的离子方程式为__。
-
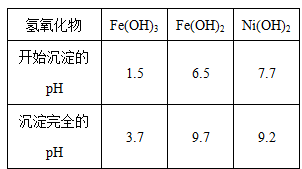
为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺。工艺流程如右图:
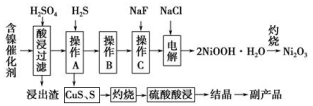
已知常温下:①有关氢氧化物开始沉淀和沉淀完全的pH如右表 ②Cu2O+2H+=Cu+Cu2++H2O③常温时,Ksp(CaF2)=2.7×10-11
回答下列问题:
(1)写出酸浸时Fe2O3和硫酸反应的化学方程式 。
(2)浸出渣主要成分为CaSO4·2H2O和 两种物质。
(3)操作B是除去滤液中的铁元素,某同学设计了如下方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH在3.7~7.7范围内,静置,过滤。请对该实验方案进行评价 (若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)流程中的“副产品”为 (填化学式)。在空气中灼烧CuS可以得到铜的氧化物,向Cu、Cu2O、CuO组成的混合物中加入1L 0.6 mol·L-1HNO3溶液恰好使混合物溶解,同时收集到2240mLNO气体(标准状况),若该混合物中含0.1molCu,与稀硫酸充分反应至少消耗 mol H2SO4。
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol·L-1,则溶液中 = 。
= 。
(6)电解产生2NiOOH·H2O的原理分两步:
①碱性条件下,Cl-在阳极被氧化为ClO-,则阳极的电极反应式为 ;
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。则该步反应的离子方程式为 。
-
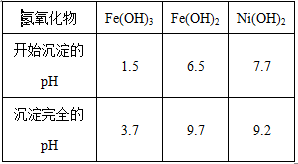
为回收利用废镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等),科研人员研制了一种回收镍的新工艺。工艺流程如右图:
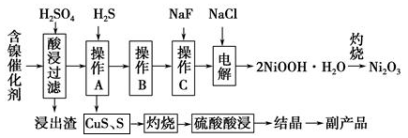
已知常温下:①有关氢氧化物开始沉淀和沉淀完pH如右表 ②Cu2O+2H+=Cu+Cu2++H2O
③常温时,Ksp(CaF2)=2.7×10-11
回答下列问题:
(1)写出酸浸时Fe2O3和硫酸反应的化学方程式 。
(2)浸出渣主要成分为CaSO4·2H2O和 两种物质。
(3)操作B是除去滤液中的铁元素,某同学设计了如下方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH在3.7~7.7范围内,静置,过滤。请对该实验方案进行评价 ________(若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)流程中的“副产品”为 (填化学式)。在空气中灼烧CuS可以得到铜的氧化物,向Cu、Cu2O、CuO组成的混合物中加入1L 0.6 mol·L-1HNO3溶液恰好使混合物溶解,同时收集到2240mLNO气体(标准状况),若该混合物中含0.1molCu,与稀硫酸充分反应至少消耗 mol H2SO4。
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol·L-1,则溶液中 = 。
= 。
(6)电解产生2NiOOH·H2O的原理分两步:
①碱性条件下,Cl-在阳极被氧化为ClO-,则阳极的电极反应为 ②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。则该步反应的离子方程式为 。
-
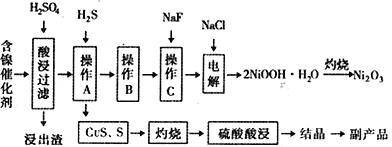
某实验科研小组研制了一种从废旧的含镍催化剂( 主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)回收镍的新工艺。工艺流程如下图:
回答下列问题:
(1)浸出渣主要成分为CaSO4↓·2H2O和_______________两种物质。
(2)右图表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是_____________________________。
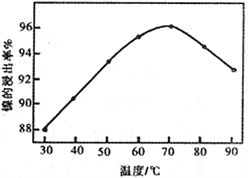
(3)工艺流程中的“副产品”为________(填化学式)。
(4)已知有关氢氧化物开始沉淀和沉淀完全的pH 如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案是否正确进行判断并做出评价: ___________________________________(若原方案正确,请说明理由;若原方案错误,请加以改正)。
(5)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则溶液中 =________________。(常温时,Ksp(CaF2)=2.7×10-11)
=________________。(常温时,Ksp(CaF2)=2.7×10-11)
(6)电解产生2NiOOH·H2O的原理分两步:
①碱性条件下Cl-在阳极被氧化为ClO-;生产1mol ClO-,消耗OH-______________mol。
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。则该步反应的离子方程式为_________________________。
-
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为:
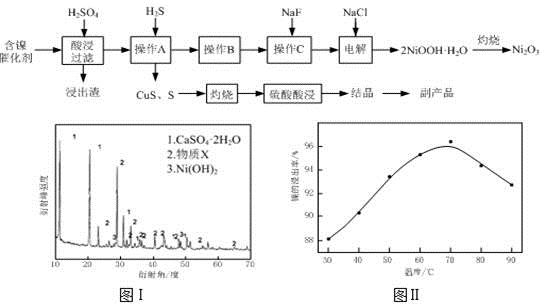
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为 。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是 。
(2)工艺流程中“副产品”的化学式为 。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价 (若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol·L-1,则Ca2+的浓度为 mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH·H2O的原理分两步:
①碱性条件下Cl-在阳极被氧化为ClO-;
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。
第②步反应的离子方程式为 。
-
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为:
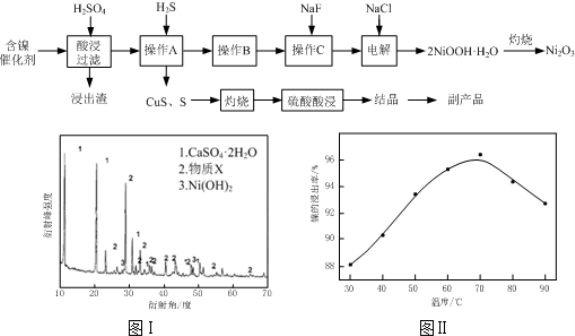
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为 。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含 量增大,其原因是 。
(2)工艺流程中“副产品”的化学式为 。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价
(若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3mol·L-1,则Ca2+的浓度为 mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH·H2O的原理分两步:
①碱性条件下Cl-在阳极被氧化为ClO-;
②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。
第②步反应的离子方程式为 。
-
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为:
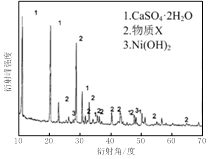
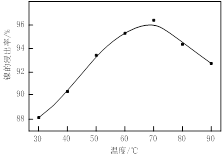
图Ⅰ 图Ⅱ
(1)根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为________。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是________。
(2)工艺流程中“副产品”的化学式为。
(3)已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价:________(若原方案正确,请说明理由;若原方案错误,请加以改正)。
(4)操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度为________mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
(5)电解产生2NiOOH·H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。第②步反应的离子方程式为________。
-
实验室模拟回收某废旧含镍催化剂(主要成分为NiO,另含Fe2O3、CaO、CuO、BaO等)生产Ni2O3。其工艺流程为:
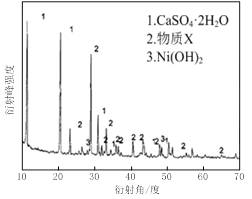
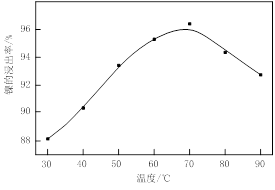
图Ⅰ 图Ⅱ
⑴根据图Ⅰ所示的X射线衍射图谱,可知浸出渣含有三种主要成分,其中“物质X”为________。图Ⅱ表示镍的浸出率与温度的关系,当浸出温度高于70℃时,镍的浸出率降低,浸出渣中Ni(OH)2含量增大,其原因是________。
⑵工艺流程中“副产品”的化学式为________。
⑶已知有关氢氧化物开始沉淀和沉淀完全的pH如下表:
| 氢氧化物 | Fe(OH)3 | Fe(OH)2 | Ni(OH)2 |
| 开始沉淀的pH | 1.5 | 6.5 | 7.7 |
| 沉淀完全的pH | 3.7 | 9.7 | 9.2 |
操作B是为了除去滤液中的铁元素,某同学设计了如下实验方案:向操作A所得的滤液中加入NaOH溶液,调节溶液pH为3.7~7.7,静置,过滤。请对该实验方案进行评价:________(若原方案正确,请说明理由;若原方案错误,请加以改正)。
⑷操作C是为了除去溶液中的Ca2+,若控制溶液中F-浓度为3×10-3 mol·L-1,则Ca2+的浓度为________mol·L-1。(常温时CaF2的溶度积常数为2.7×10-11)
⑸电解产生2NiOOH·H2O的原理分两步:①碱性条件下Cl-在阳极被氧化为ClO-;②Ni2+被ClO-氧化产生2NiOOH·H2O沉淀。第②步反应的离子方程式为________。
















