-
高锰酸钾是一种典型的强氧化剂,热分解产生锰酸钾、二氧化锰、氧气。完成下列填空:
I. 已知:①MnO2(s)=Mn(s)+O2(g) ΔH=+520kJ/mol
②S(s)+O2(g)=SO2(g) ΔH=-297kJ/mol
③Mn(s)+2O2(g)+S(s)=MnSO4(s) ΔH=-1065kJ/mol
(1)固体MnO2和二氧化硫气体反应生成MnSO4固体的热化学方程式为________________。
II.草酸钠滴定法测定高锰酸钾的质量分数涉及到的反应:
C2O42-+2H+→H2C2O4(草酸)
5H2C2O4+2MnO4-+6H+→2Mn2++10CO2↑+8H2O
(2)上述反应在75~80℃进行比较合适,当加热温度大于90℃时,会导致草酸钠消耗增多,其原因是______________________。
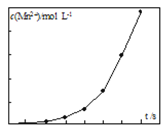
(3)将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应溶液中Mn2+的浓度随反应时间t的变化如图,Mn2+浓度变化由缓慢增大后迅速增大的原因是____________________________。
III .KMnO4是一种常用消毒剂。
(4)KMnO4消毒机理与下列物质相似的是__________(填序号)。
A. 双氧水 B.消毒酒精(75%) C.肥皂水 D. 84消毒液(NaClO溶液)
(5)KMnO4消毒效率(用单位质量转移的电子数表示)是NaClO的______倍(保留两位小数)。
(6)测定KMnO4产品的纯度可用标准Na2SO3溶液滴定。
①配制250ml0.1000mol/L标准Na2SO3溶液,需要使用的玻璃仪器有烧杯、胶头滴管、量筒、玻璃棒和____________。
②取某KMnO4产品0.7000g溶于水,并加入____________进行酸化。
A. 稀盐酸 B.稀硫酸 C.硝酸 D. 次氯酸
③将②所得溶液用0.1000mol/L标准Na2SO3溶液进行滴定,滴定至终点记录实验消耗Na2SO3溶液的体积。重复步骤②、③,三次平行实验数据如表:
| 实验次数 | 1 | 2 | 3 |
| 消耗Na2SO3溶液体积/ml | 19.30 | 20.98 | 21.02 |
(有关离子方程式为:2MnO4- + 5SO32- + 6H+ =5SO42- + 2Mn2+ + 3H2O)
计算该KMnO4产品的纯度为__________。(保留三位有效数字)
-
高锰酸钾是一种典型的强氧化剂,热分解产生锰酸钾、二氧化锰、氧气。完成下列填空:
I.已知:①MnO2(s)=Mn(s)+O2(g) ΔH=+520kJ/mol,②S(s)+O2(g)=SO2(g)ΔH=-298kJ/mol,③Mn(s)+2O2(g)+S(s)=MnSO4(s) ΔH=-1068kJ/mol。
(1)固体MnO2和二氧化硫气体反应生成MnSO4固体的热化学方程式为_____。
Ⅱ.草酸钠滴定法测定高锰酸钾的质量分数涉及到的反应:C2O42-+2H+→H2C2O4(草酸),5H2C2O4+2MnO4-+6H+→2Mn2++10CO2↑+8H2O
(2)将一定量高锰酸钾溶液与酸化的草酸钠溶液混合,测得反应溶液中Mn2+的浓度随反应时间t的变化如图,Mn2+浓度变化由缓慢增大后迅速增大的原因是_______。

Ⅲ.KMnO4是一种常用消毒剂。
(3)KMnO4消毒机理与下列物质相似的是____(填序号)。
A.消毒酒精(75%) B. 双氧水 C. 84消毒液 D. 肥皂水 E.活性炭 F.SO2
(4)测定KMnO4产品的纯度可用标准Na2S2O3溶液滴定。
①配制500ml0.1000mol/L标准Na2SO3溶液,需要使用的玻璃仪器有烧杯、量筒、玻璃棒和___。
②取KMnO4粗产品0.7000g溶于水,并加入稀硫酸进行酸化,将所得溶液用0.1000mol/L标准Na2S2O3溶液进行滴定,滴定至终点记录实验消耗Na2S2O3溶液的体积。重复步骤②、③,三次平行实验数据如表:
| 实验次数 | 1 | 2 | 3 |
| 消耗Na2SO3溶液体积/ml | 19.30 | 20.98 | 21.02 |
(已知:S2O32-被MnO4-氧化为SO42- )
计算该KMnO4产品的纯度为___。(保留三位有效数字)
-
高锰酸钾是一种典型的强氧化剂。
完成下列填空:
Ⅰ.在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① MnO4-+ Cu2S + H+→ Cu2+ + SO2↑ + Mn2+ + H2O(未配平)
② MnO4-+ CuS + H+ → Cu2+ + SO2↑ + Mn2++ H2O(未配平)
(1)下列关于反应①的说法中错误的是(选填编号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8:5
c.生成2.24 L(标况下) SO2,转移电子的物质的量是0.8 mol
d.还原性的强弱关系是: Mn2+> Cu2S
(2)标出反应②中电子转移的方向和数目: MnO4-+ CuS
Ⅱ.在稀硫酸中,MnO4-和H2O2也能发生氧化还原反应
氧化反应:H2O2 -2e → 2H+ + O2↑
还原反应:MnO4- + 5e + 8H+ → Mn2+ + 4H2O
(3)反应中若有0.5 mol H2O2参加此反应,转移电子的个数为 。由上述反应得出的物质氧化性强弱的结论是>___________(填写化学式)。
(4)已知:2KMnO4+ 7H2O2+3H2SO4→ K2SO4+2MnSO4 +6O2↑+10H2O,则被1mol KMnO4氧化的H2O2是
________ mol。
-
(18分) 高锰酸钾是一种典型的强氧化剂。完成下列填空:
I:在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① MnO +Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)
+Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)
② MnO +CuS +H+→Cu2++SO2↑+Mn2++H2O(未配平)
+CuS +H+→Cu2++SO2↑+Mn2++H2O(未配平)
(1)下列关于反应①的说法中错误的是 (填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8∶5
c.生成2.24 L(标况下)SO2,转移电子的物质的量是0.8 mol
d.还原性的强弱关系是:Mn2+>Cu2S
(2)标出反应②配平后2种反应物前面的系数: MnO + CuS+…..
+ CuS+…..
II:在稀硫酸中,MnO 和H2O2也能发生氧化还原反应
和H2O2也能发生氧化还原反应
氧化反应:H2O2-2e-===2H++O2↑
还原反应:MnO +8H++5e-===Mn2++4H2O
+8H++5e-===Mn2++4H2O
(3)反应中若有0.5 mol H2O2参加此反应,转移电子的个数为 。
(4)已知:2KMnO4+7H2O2+3H2SO4===K2SO4+2MnSO4+6O2↑+10H2O,则被1 mol KMnO4氧化的H2O2是 mol。
III:实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3(s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。
请回答:
(5)用软锰矿制备K2MnO4的化学方程式是: 。
(6)K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为 。KMnO4、K2MnO4和MnO2的氧化性由强到弱的顺序是 。(用“>”“<”或“=”表示)。
-
高锰酸钾是一种典型的强氧化剂。
完成下列填空:
Ⅰ.在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① +Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)
+Cu2S+H+→Cu2++SO2↑+Mn2++H2O(未配平)
② +CuS+H+→Cu2++SO2↑+Mn2++H2O(未配平)
+CuS+H+→Cu2++SO2↑+Mn2++H2O(未配平)
(1)下列关于反应①的说法中错误的是______(填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8∶5
c.生成2.24 L(标况下)SO2,转移电子的物质的量是0.8 mol
d.还原性的强弱关系是:Mn2+>Cu2S
Ⅱ.在稀硫酸中, 和H2O2也能发生氧化还原反应
和H2O2也能发生氧化还原反应
氧化反应:H2O2−2e− 2H++O2↑
2H++O2↑
还原反应: +5e−+8H+
+5e−+8H+ Mn2++4H2O
Mn2++4H2O
(2)反应中若有0.5 mol H2O2参加此反应,转移电子的个数为________。
(3)已知:2KMnO4+7H2O2+3H2SO4 K2SO4+2MnSO4+6O2↑+10H2O,则被1 mol KMnO4氧化的H2O2是______mol。
K2SO4+2MnSO4+6O2↑+10H2O,则被1 mol KMnO4氧化的H2O2是______mol。
Ⅲ.高锰酸钾溶液与硫化亚铁有如下反应:10FeS+6KMnO4+24H2SO4 3K2SO4+6MnSO4+5Fe2(SO4)3+10S+24H2O
3K2SO4+6MnSO4+5Fe2(SO4)3+10S+24H2O
(4)若上述反应前后固体的质量减少了2.8 g,则硫元素与KMnO4之间发生电子转移的数目为____________个。
-
高锰酸钾是一种典型的强氧化剂。完成下列填空:
I:在用KMnO4酸性溶液处理Cu2S和CuS的混合物时,发生的反应如下:
① MnO4-+Cu2S+H+ Cu2++SO2↑+Mn2++H2O(未配平)
Cu2++SO2↑+Mn2++H2O(未配平)
② MnO4-+CuS +H+ Cu2++SO2↑+Mn2++H2O(未配平)
Cu2++SO2↑+Mn2++H2O(未配平)
(1)下列关于反应①的说法中错误的是 (填字母序号)。
a.被氧化的元素是Cu和S
b.氧化剂与还原剂的物质的量之比为8∶5
c.生成2.24 L(标况下)SO2,转移电子的物质的量0.8 mol d.还原性的强弱:Mn2+>Cu2S
II:在稀硫酸中,KMnO4与 (NH4)2Fe(SO4)2也能发生氧化还原反应。
(2)写出KMnO4与(NH4)2Fe(SO4)2反应的离子方程式: 。
(3)欲配制480mL 0.1mol/L Fe2+溶液,需称取(NH4)2Fe(SO4)2·6H2O(M=392g/mol)的质量为 g。需要的玻璃仪器有 .
III:实验室可由软锰矿(主要成分为MnO2)制备KMnO4,方法如下:高温下使软锰矿与过量KOH(s)和KClO3(s)反应,生成K2MnO4(锰酸钾)和KCl;用水溶解,滤去残渣;酸化滤液,K2MnO4转化为MnO2和KMnO4;再滤去沉淀MnO2,浓缩结晶得到KMnO4晶体。请回答:
(4)用软锰矿制备K2MnO4的化学方程式是: 。
(5)K2MnO4转化为KMnO4的反应中氧化剂和还原剂的物质的量之比为 。并用单线桥表示电子的转移情况 。
-
某同学对MnO2、CuO、Fe2O3、Cr2O3在氯酸钾受热分解反应中的催化作用进行了研究。实验所得数据如下表。就本实验的有关问题,请填空:
| 实验编号 | KClO3(g) | 氧化物 | 产生气体(mL)(已折算为标况) | 耗时(s) |
| 化学式 | 质量(g) | 实际回收 |
| 1 | 0.6 | — | — | — | 10 | 480 |
| 2 | 0.6 | MnO2 | 0.20 | 90% | 67.2 | 36.5 |
| 3 | 0.6 | CuO | 0.20 | 90% | 67.2 | 79.5 |
| 4 | 0.6 | Fe2O3 | 0.20 | 90% | 67.2 | 34.7 |
| 5 | 0.6 | Cr2O3 | 0.20 | 异常 | 67.2 | 188.3 |
| | | | | | |
(1)本实验的装置由下图三部分组成,其正确的接口连接顺序为 。
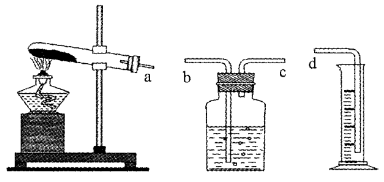
(2)为证明编号2的实验中MnO2起到催化作用,还要测定反应剩余物中MnO2的质量,实验的操作顺序是:溶解→ 。
(3)写出实验室中通过编号2制取氧气的化学方程式:
(4)从上表实验数据分析,对氯酸钾受热分解有催化作用的物质,按其催化能力从大到小的顺序为 (填物质的化学式)。
(5)在进行编号5的实验时,有刺激性的黄绿色气体产生,该气体可能是 (填化学式),可用 试纸检验该气体,上述异常现象产生的原因是 。
-
过氧化氢在二氧化锰催化作用下分解放出氧气的反应机理如下:
①MnO2+H2O2+2H+===Mn2++O2↑+2H2O
②Mn2++H2O2===MnO2+2H+
下列说法正确的是
A.H2O2在①中是氧化剂,在②中是还原剂
B.Mn2+在①中是还原产物,在②中是氧化产物
C.在①中每生成1 mol O2,转移的电子数为2.408×1024
D.在二氧化锰催化作用下1 mol H2O2分解生成0.5 mol O2
-
已知高锰酸钾、二氧化锰在酸性条件下能将草酸钠(Na2C2O4)氧化:
MnO +C2O
+C2O +H+→Mn2++CO2↑+H2O(未配平);
+H+→Mn2++CO2↑+H2O(未配平);
MnO2+C2O +H+→Mn2++CO2↑+H2O(未配平).
+H+→Mn2++CO2↑+H2O(未配平).
为测定某软锰矿中二氧化锰的质量分数,准确称量1.20g软锰矿样品,加入2.68g草酸钠固体,再加入足量的稀硫酸并加热(杂质不参加反应),充分反应后冷却,将所得溶液转移到容量瓶中用蒸馏水稀释至刻度,从中取出25.0mL,用0.0200mol•L-1高锰酸钾溶液进行滴定.当加入20.0mL溶液时恰好完全反应,试根据以上信息完成下列各题:
(1)配平上述两个离子方程式:
______MnO +______C2O
+______C2O +______H+═______Mn2++______CO2↑+______H2O;
+______H+═______Mn2++______CO2↑+______H2O;
______MnO2+______C2O +______H+═______Mn2++______CO2↑+______H2O.
+______H+═______Mn2++______CO2↑+______H2O.
(2)欲求得软锰矿中二氧化锰的质量分数,还缺一个数据,这个数据是______(填数据所代表的意义).
(3)若该数据的数值为250,求该软锰矿中二氧化锰的质量分数(写出计算过程).
-
苯甲酸广泛应用于制药和化工行业,某兴趣小组同学利用高锰酸钾氧化甲苯制备苯甲酸(KMnO4中性条件下还原产物为MnO2,酸性条件下为Mn2+)

已知:苯甲酸相对分子量122,熔点122.4℃,在25℃和95℃时溶解度分别为0.3 g和6.9 g。
实验流程:
①往装置A中加入2.7mL(2.3 g)甲苯和125 mL水,然后分批次加入8.5 g稍过量的KMnO4固体,控制反应温度约在100℃,当甲苯层近乎消失,回流不再出现油珠时,停止加热。
②将反应混合物趁热过滤,用少量热水洗涤滤渣,合并滤液与洗涤液,冷却后加入浓盐酸,经操作I得白色较干燥粗产品。
③纯度测定:称取1.220g白色样品,配成100mL苯甲酸溶液,取25.00mL溶液,用0.1000mol/L KOH标准溶液滴定,重复滴定四次,每次消耗的体积如下表所示。
| 第一次 | 第二次 | 第三次 | 第四次 |
| 体积(mL) | 24.00 | 24.10 | 22.40 | 23.90 |
请回答:
(1)装置A的名称 。若不用温度计,本实验控制反应温度的措施为 。
(2)白色粗产品中除了KCl外,其他可能的无机杂质为____ 。
(3)操作②中趁热过滤的目的是 ,操作I的名称 。
(4)步骤③中用到的定量仪器有分析天平, ,50mL酸式、碱式滴定管。
(5)样品中苯甲酸纯度为 。
(6)滴定操作中,如果对装有KOH标准溶液的滴定管读数时,滴定前仰视,滴定后俯视则测定结果将 (填“偏大”、“偏小”或“不变”)。



