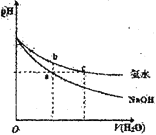
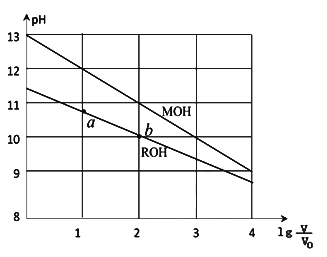
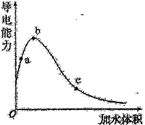
-
25°C时,0.1 mol/L的醋酸溶液中H+的浓度为a mol/L,0.01 mol/L的醋酸溶液中H+浓度为b mol/L,则a:b_______10。(填“大于”、“小于”或“等于”)。
难度: 中等查看答案及解析
-
25℃,CH3COOH的电离常数Ka=1.75×10-5。
(1)计算0.1 mol·L-1的CH3COOH溶液中c(H+)=__________________;
(2)0.1 mol·L-1的CH3COOH和0.1 mol·L-1的CH3COONa的混合溶液中,c(H+)=_____________;
(3)25°C,将0.1 mol·L-1的CH3COOH溶液加水稀释,请填写下列表达式中的数据情况(填“变大”、“变小”或“不变”)。
①
=____________;
②
=____________;
③
=____________;
④
=____________。
难度: 中等查看答案及解析
-
(1)25°C时,若向a mol·L-1的HA溶液中,滴加等体积的b mol·L-1的NaOH溶液,使溶液呈中性,用含a的代数式表示HA的电离平衡常数Ka=____________。
(2)25°C时,将a mol·L-1的氨水与0.01 mol·L-1的盐酸等体积混合,反应完后溶液中c(NH4+)=c(Cl-),则溶液显_____性(填“酸”、“碱”或“中”),用含a的代数式表示NH3·H2O的电离平衡常数Kb=____________。
难度: 困难查看答案及解析
-
已知常温下H2C2O4的电离平衡常数Ka1=5.4×10-2,Ka2=5.4×10-5,反应NH3·H2O+HC2O4-=NH4++C2O42-+H2O的平衡常数K=9.45×104,则NH3·H2O的电离平衡常数Kb=______________。
难度: 中等查看答案及解析
-
25 ℃,两种酸的电离平衡常数如下表。
Ka1
Ka2
H2SO3
1.3×10-2
6.3×10-8
H2CO3
4.2×10-7
5.6×10-11
(1)HSO
的电离平衡常数表达式K=______________________________。
(2)H2SO3溶液和NaHCO3溶液反应的主要离子方程式为_______________。
难度: 简单查看答案及解析
-
下表是室温下,几种弱酸的电离平衡常数(Ka)和弱碱的电离平衡常数(Kb):
酸或碱
电离常数(Ka或Kb)
CH3COOH
Ka=1.75×10-5
柠檬酸(H3C6H5O7)
Ka1=7.4×10-4
Ka2=1.73×10-5
Ka3=4.0×10-7
NH3·H2O
Kb=1.75×10-5
请回答下列问题:
(1)用蒸馏水稀释0.1 mol/L的醋酸溶液,下列选项中一定变小的是__________(填字母)。
A.
B.c(H+)
C.c(OH-)·c(H+)
D.
E.
(2)浓度为0.10 mol/L柠檬酸氢二钠(Na2HC6H5O7)溶液显_____(填“酸”“碱”或“中”)性,通过计算说明其原因____
难度: 中等查看答案及解析
-
(1)0.1 mol/L醋酸溶液中,存在电离平衡CH3COOH
H++CH3COO-。经测定溶液中c(CH3COO―)为1.4×10-3 mol/L,此温度下醋酸的电离平衡常数Ka=________。
(2)已知饱和硫化氢的浓度为0.1 mol/L,硫化氢的电离常数为Ka1=1.0×10-7,Ka2=1.0×10-19,计算饱和硫化氢溶液中氢离子的浓度为__________mol/L。
难度: 中等查看答案及解析
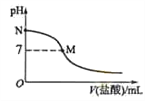
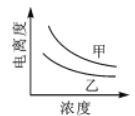 B.
B. C.
C.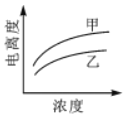 D.
D.