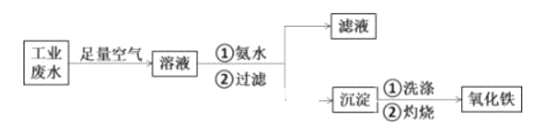
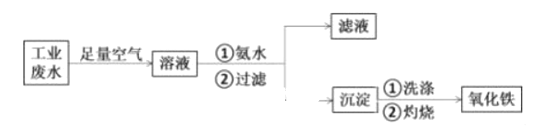
-
已知25℃,醋酸、次氯酸、碳酸、亚硫酸的电离平衡常数如下表,下列叙述正确的是( )
酸
电离平衡常数
醋酸
Ki=1.75×10-5
次氯酸
Ki=2.98×10-8
碳酸
Ki1=4.30×10-7
Ki2=5.61×10-11
亚硫酸
Ki1=1.54×10-2
Ki2=1.02×10-7
A. 将0.1 mol/L的醋酸加水不断稀释,c(CH3COO-)始终减小
B. 少量CO2通入NaClO溶液中反应的离子方程式为:CO2+H2O+2ClO-=CO32-+2HClO
C. 少量的SO2通入Ca(ClO)2溶液中反应的离予方程式为:SO2+H2O+Ca2++2ClO-=CaSO3↓+2HClO
D. 25℃,等浓度的CH3COONa、NaClO、Na2CO3和Na2SO3溶液中,碱性最强的是NaClO
难度: 困难查看答案及解析
-
常温下,浓度均为0.1mol/L的四种溶液pH如下表,依据已有的知识和信息判断,下列说法正确的是( )
溶质
Na2CO3
NaClO
NaHCO3
NaHSO3
pH
11.6
10.3
9.7
4.0
A. 常温下,HSO3¯的水解能力强于其电离能力
B. 常温下,相同物质的量浓度的H2SO3、H2CO3、HClO,pH依次升高
C. Na2CO3溶液中存在以下关系:c(Na+)+c(H+)=c(CO32¯)+c(HCO3¯)+c(OH¯)
D. 向氯水中加入少量NaHCO3固体,不能增大HClO的浓度
难度: 困难查看答案及解析
-
已知短周期主族元素X、Y、Z、W、R五种元素,原子序数依次增大,X元素的原子是所有元素中原子半径最小的,Y、W同主族,Z、W同周期.X与Y可形成具有18个电子的化合物G,在酸性条件下,在含W阴离子的溶液中加入G可得到W单质,Z是同周期中金属性最强的元素。下列说法不正确的是( )
A. 原子半径:X<Y<W<R<Z
B. 由Y、Z元素可形成两种离子化合物其阳离子与阴离子物质的量之比都是2:1
C. 沸点:X2Y>X2W
D. W与R可形成共价化合物WR2,且WR2是极性分子
难度: 中等查看答案及解析
-
对于0.1mol·L-1Na2SO3溶液,正确的是
A.升高温度,溶液的pH降低
B.c(Na+)=2c(SO32-)+c(HSO3-)+c(H2SO3)
C.c(Na+)+c(H+)=2 c(SO32-)+ 2c(HSO3-)+ c(OH-)
D.加入少量NaOH固体,c(SO32-)与c(Na+)均增大
难度: 中等查看答案及解析
-
用标准的NaOH溶液滴定未知浓度的盐酸,选用酚酞为指示剂,造成测定的盐酸浓度偏高的原因可能是( )
A.未用标准液润洗碱式滴定管
B.滴定到终点读数时,俯视滴定管的刻度,其他操作均正确
C.盛装未知液的锥形瓶用蒸馏水洗过,未用待测液润洗
D.滴定前,滴定管尖嘴部分无气泡,到终点读数时发现滴定管尖嘴内有气泡
难度: 简单查看答案及解析
-
室温下,一定体积pH=12的Ba(OH)2溶液中,逐滴加入一定物质的量浓度的Na2SO4溶液,当溶液中的Ba2+恰好完全沉淀时,溶液的pH=11(忽略反应前后的体积变化),则Ba(OH)2溶液与Na2SO4溶液的体积比是( )
A.1:9 B.1:1 C.1:2 D.1:4
难度: 简单查看答案及解析
-
电化学降解法可用于治理水中硝酸盐的污染,其原理如图。下列说法不正确的是( )
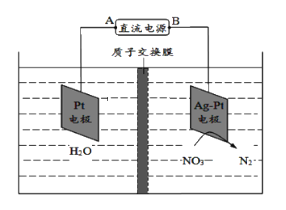
A.A为电源正极
B.在Pt电极上发生氧化反应
C.阴极的电极反应式为:2NO3- + 6H2O + 10e- = N2 + 12OH-
D.若电路转移10mol e-,质子交换膜右侧溶液质量减少18g
难度: 中等查看答案及解析
-
常温下,下列各组离子在指定溶液中一定能大量共存的是
A. 水电离的c(H+)=1×10-13mol/L 的溶液中:K+、Na+、SiO32-、SO42-
B. 1.0mol/L的CH3COOH溶液:K+、Fe3+、NO3-、Cl-
C. 在c(OH-):c(H+)=1×1012的溶液: NH4+、Ca2+、Cl-、K+
D. 滴入酚酞试剂不变色的溶液:Na+、CO32-、NO3-、SO32-
难度: 困难查看答案及解析
-
在K2S溶液中存在着多种分子和离子,下列关系错误的是 ( )
A.c(K+)+ c(H+)= 2 c(S 2-)+ c(HS -)+ c(OH-)
B.c(OH-)= c(HS -)+ c(H+)+ 2c(H2S)
C.c(K+)= 2 [c(HS -)+ c(S 2-) + c(H2S)]
D.c(OH-)= c(HS -)+ c(H+)+ c(H2S)
难度: 中等查看答案及解析
-
草酸是二元弱酸,草酸氢钾溶液呈酸性。在0.1mol·L-1 KHC2O4溶液中,下列关系正确的是
A.c(K+)+c(H+) = c(HC2O4-)+c(OH-)+c(C2O42-)
B.c(HC2O4-)+c(C2O42-) = 0.1 mol·L-1
C.c(C2O42-) < c(H2C2O4)
D.c(K+) = c(H2C2O4)+c(HC2O4-)+c(C2O42-)
难度: 中等查看答案及解析
-
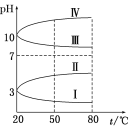
一定条件下的可逆反应CO(g)+2H2(g)
CH3OH(g) △H <0,按照相同的物质的量投料,测得CO在不同温度下的平衡转化率与压强的关系如图所示。下列说法正确的是( )
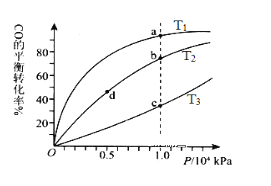
A.温度:T1< T2 <T3
B.正反应速率:ν(a)>ν(c); ν(b)>ν(d)
C.平衡常数: K(a) =K(c) ;K(b) >K(d)
D.平均摩尔质量:M(a)<M(c);M(b)>M(d)
难度: 中等查看答案及解析
-
25℃时,向20mL0.1mol·L-1H3PO2溶液中滴加0.1mol·L-1的NaOH溶液,滴定曲线如图1,含磷微粒物质的量浓度所占分数(δ)随pH变化关系如图2。下列说法不正确是
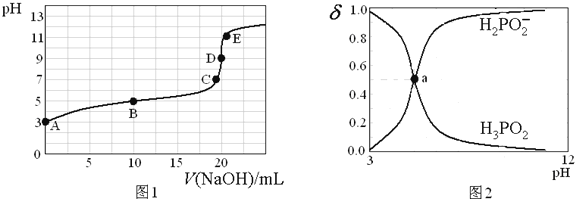
A. H3PO2的电离方程式为H3PO2
H2PO2-+H+ Ka≈10-5
B. B点时,溶液中存在关系:2c(H+)+c(H2PO2-)=2c(OH-)+c(H3PO2)
C. C点时,溶液中存在关系:c(Na+)+c(H+)=C(H2PO2-)+c(OH-)
D. D点时,溶液中微粒浓度大小关系:c(Na+)>c(H2PO2-)>c(OH-)>c(H+)
难度: 困难查看答案及解析
-
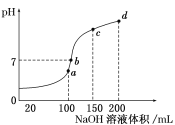
常温下将NaOH溶液滴加到己二酸(H2X)溶液中,混合溶液的pH与离子浓度变化的关系如图所示。下列叙述正确的是( )
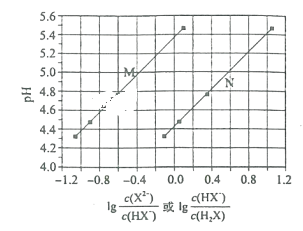
A.Ka1(H2X)的数量级为10-5
B.曲线N表示pH与lg
的变化关系
C.NaHX溶液显碱性
D.当混合溶液呈中性时,c(Na+)>c(HX-)>c(X2-)>c(OH-)=c(H+)
难度: 中等查看答案及解析
-
下列有关金属腐蚀与防护的说法正确的是( )
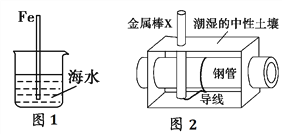
A.图1中,插入海水中的铁棒,越靠近底端,腐蚀越严重
B.镀层破损后,镀锌铁比镀锡铁更耐用
C.纯银器表面在空气中因电化学腐蚀渐渐变暗
D.图2中,金属棒X若为Cu,可使埋在地下的钢管免受腐蚀
难度: 中等查看答案及解析
-
常温下,下列叙述正确的是( )
A.盐酸溶液的导电能力一定比醋酸溶液的强
B.在滴有酚酞溶液的氨水中,加入NH4Cl的溶液恰好无色,则此时溶液的pH< 7
C.向10mL 0.1mol·L-1的CH3COOH溶液中滴加相同浓度的氨水,在滴加过程中,
 将减小
将减小D.用已知浓度的NaOH溶液滴定未知浓度的醋酸溶液,最好选用甲基橙作指示剂
难度: 中等查看答案及解析
-
下列说法中正确的是( )
A.水处理中用可溶性的铝盐和铁盐处理水中的悬浮物
B.制备无水AlCl3,可加热蒸发Al与稀盐酸反应后的溶液
C.配制FeCl3溶液时,将FeCl3固体溶解在硫酸中,然后再用水稀释到所需的浓度
D.泡沫灭火器中常使用的原料是碳酸钠和硫酸铝
难度: 中等查看答案及解析
-
对水垢的主要成分是CaCO3和Mg(OH)2而不是CaCO3和MgCO3的解释,说法正确的是
A. Mg(OH)2的溶度积大于MgCO3的溶度积,且在水中发生了沉淀转化
B. Mg(OH)2比MgCO3更难溶,且在水中发生了沉淀转化
C. MgCO3电离出的CO
发生水解,使水中OH-浓度减小,对Mg(OH)2沉淀溶解平衡而言,Qc<Ksp,生成Mg(OH)2沉淀
D. 二者不能相互转化
难度: 中等查看答案及解析
-
已知:H2(g)+F2(g)=2HF(g);ΔH= -270 kJ/mol,下列说法正确的是( )
A.氟化氢气体分解生成氢气和氟气的反应是放热反应
B.1mol H2与1mol F2反应生成2mol液态HF放出的热量小于270kJ
C.在相同条件下,1mol H2与1mol F2的能量总和大于2mol HF气体的能量
D.该反应中的能量变化可用如图来表示

难度: 简单查看答案及解析
-
下列浓度关系正确的是( )
A. 0.1 mol/L的NH4HSO4溶液中滴加0.1mol/L的Ba(OH)2溶液至沉淀刚好完全:c(NH4+)>c(OH-)>c(SO42-)>c(H +)
B. 若将CO2通入0.1mol/L Na2CO3溶液至溶液中性,则溶液中: 2c(CO32-)+c(HCO3-)=0.1mol/L
C. 0.1mol/L的NaOH溶液与0.2mol/L的HCN溶液等体积混合,所得溶液呈碱性:c(Na+)>c(CN-)>c(HCN)>c(OH-)>c(H+)
D. 向1L 1mol/L的KOH热溶液中通入一定量的Cl2,恰好完全反应生成氯酸钾、次氯酸钾和氯化钾的混合溶液: c(K+)+c(H+)=6c(ClO3-)+2c(ClO-)+c(HClO)+c(OH-)
难度: 困难查看答案及解析
-
已知某温度下AgCl(s)的溶度积常数Ksp=1×10-10。在该温度下,向50mL 0.018mol/L的AgNO3溶液中加入50mL 0.02mol/L的盐酸,生成沉淀(混合后溶液的体积变化忽略不计)。下列说法正确的是()
A.AgCl的溶解性为难溶,则该物质不溶于水
B.沉淀生成后,溶液中Ag+的浓度1×10-5mol/L
C.沉淀生成后,溶液中NO3-的浓度1.8×10-2mol/L
D.沉淀生成后,溶液的pH为2
难度: 中等查看答案及解析
-
下列有关说法中正确的是()
A.Ksp(AB2)<Ksp(CD),说明AB2 的溶解度小于CD 的溶解度
B.在ZnS的沉淀溶解平衡体系中加入蒸馏水,ZnS的Ksp增大
C.AgCl 分别在同浓度的CaCl2溶液和NaCl 溶液中溶解度不同
D.在CaCO3的沉淀溶解平衡体系中加入稀盐酸,沉淀溶解平衡不移动
难度: 中等查看答案及解析
-
将a L NH3通入某恒压的密闭容器中,在一定条件下让其分解,达到平衡后气体体积增大到b L(气体体积在相同条件下测定)。下列说法中正确的是( )
A.平衡后氨气的分解率为
B.平衡混合气体H2的体积分数为
C.反应前后气体的密度比为
D.平衡后气体的平均摩尔质量为
难度: 中等查看答案及解析