-
化学与人类生产、生活密切相关,下列有关说法不正确的是
A.向海水中加入净水剂明矾可以使海水淡化
B.将“地沟油”变废为宝,可制成生物柴油加以利用
C.用活性炭为糖浆脱色和用SO2漂白纸浆的原理不同
D.水泥和冶金工厂常用高压电除去工厂烟尘,利用了胶体的性质
难度: 中等查看答案及解析
-
同分异构现象在有机物中广泛存在,如图为苯及其几种同分异构体的键线式,下列有关说法中正确的是
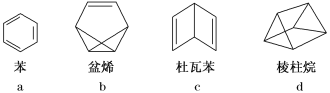
A. b、c均与乙烯互为同系物
B. a和d的二氯代物均有3种
C. 4种有机物均能使酸性高锰酸钾溶液褪色
D. a和b中所有原子可能共平面
难度: 中等查看答案及解析
-
某小组设计如图所示装置(夹持装置略去) 模拟侯氏制碱工艺制备NaHCO3。下列说法错误的是
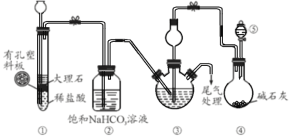
A.装置①也可用于制取H2
B.③、⑤中可分别盛放饱和食盐水和浓氨水
C.应先向③中通入足量NH3,再通入足量CO2
D.实验中产生的尾气可以通过浓NaOH溶液处理
难度: 中等查看答案及解析
-
中国学者在水煤气变换[CO(g)+H2O(g)=CO2(g)+H2(g) ΔH]中突破了低温下高转化率与高反应速率不能兼得的难题,该过程是基于双功能催化剂(能吸附不同粒子)催化实现的,反应过程示意图如下:
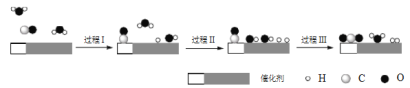
下列说法正确的是
A.过程Ⅰ和过程Ⅲ均为放热过程
B.图示过程中的H2O均参与了反应过程
C.过程Ⅲ生成了具有极性共价键的H2、CO2
D.使用催化剂降低了水煤气变换反应的ΔH
难度: 中等查看答案及解析
-
双极膜电渗析一步法盐制酸碱的技术进入到了工业化阶段,某科研小组研究采用BMED膜堆(如图所示),模拟以精制浓海水为原料直接制备酸和碱。BMED膜堆包括阳离子交换膜、阴离子交换膜和双极膜(a、d)已知:在直流电源的作用下,双极膜内中间界面层发生水的解离,生成H+和OH-。下列说法正确的是
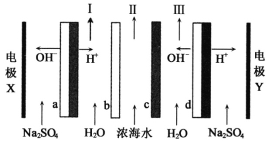
A. 电极Y连接电源的正极,发生还原反应
B. I口排出的是混合碱,Ⅱ口排出的是淡水
C. 电解质溶液采用Na2SO4溶液可避免有害气体的产生
D. a左侧膜为阳离子交换膜,c为阴离子交换膜
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增加。A是元素Y的单质。常温下,甲的浓溶液和A发生钝化。丙、丁、戊是由这些元素组成的二元化合物,且丙是无色气体。上述物质的转化关系如图所示。下列说法正确的是

A.丁和戊中所含元素种类相同
B.简单离子半径大小:X<Y
C.气态氢化物的还原性:X>Z
D.Y的简单离子与Z的简单离子在水溶液中可大量共存
难度: 中等查看答案及解析
-
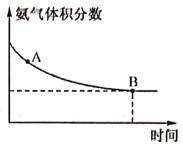
25℃时,将浓度均为0.1 mol/L的HA溶液与BOH溶液按不同体积比混合,以Va和Vb、分别代表酸和碱的体积,保持Va+Vb=100 mL,Va、Vb与混合液pH的关系如图所示,下列说法正确的是
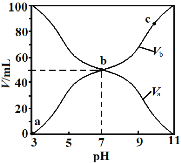
A.c点时,c(A-)>c(B+)
B.Ka(HA)=Kb(BOH)=1×10-6
C.a→c过程中
不变
D.b点时,c(A-)=c(B+)=c(H+)=c(OH-)
难度: 中等查看答案及解析
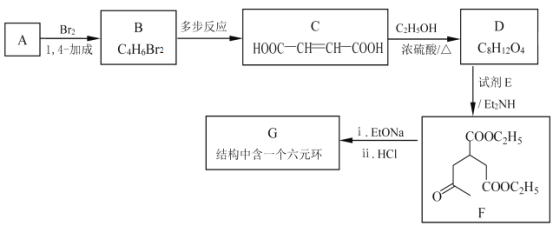
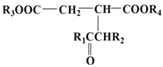
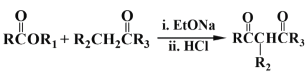 +R1OH
+R1OH 结构,其中R1、R2分别代表氢或其他基团
结构,其中R1、R2分别代表氢或其他基团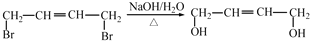 →__________________________。
→__________________________。