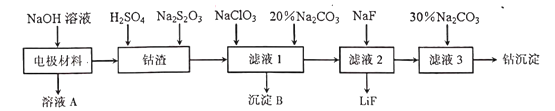
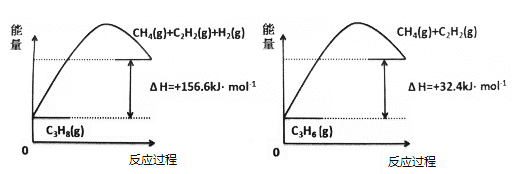
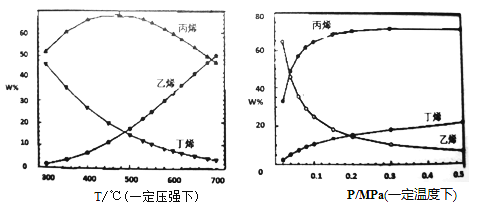
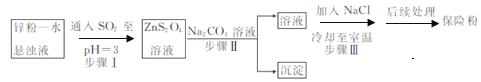
-
化学与生产、生活密切相关,下列有关说法正确的是( )
A.工业上用电解MgO、Al2O3的方法来冶炼对应的金属
B.煤的气化、液化与石油的裂化、裂解均为化学变化
C.“血液透析”和“静电除尘”利用了胶体的同一种性质
D.刚玉主要成分是氧化铝,玛瑙、分子筛主要成分是硅酸盐
难度: 中等查看答案及解析
-
下列有关实验操作对应的现象及结论都正确且二者存在因果关系的是
选项
实验
现象
结论
A
向等体积等浓度的H2O2溶液中分别加入5滴等浓度的CuSO4和KMnO4溶液
观察、对比气体产生的速度
可比较CuSO4和KMnO4的对H2O2分解的催化效果
B
向植物油和矿物油中分别加入烧碱溶液,加热
冷却后观察到其一分层,另一不分层
分层的是矿物油,不分层的是植物油
C
将浓硫酸滴到胆矾晶体表面
晶体表面出现黑斑
浓硫酸具有脱水性
D
SO2通入Ba(NO3)2溶液
产生白色沉淀
SO2与可溶性钡盐均可生成白色沉淀
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
NA代表阿伏加德罗常数的值。下列说法正确的是( )
A.标准状况下,11.2 L Cl2溶于水,溶液中Cl-,ClO-和HClO的微粒数之和为NA
B.32.5 g FeCl3水解形成的Fe(OH)3胶体粒子数为0.2NA
C.1 mol PC13与1 mol 36C12反应达到平衡时,产物中含P—36C1键数目为2NA
D.反应
+
→
+
中,每生成294g
释放的中子数为3NA
难度: 中等查看答案及解析
-
A、B、C、D为原子序数依次增大的短周期主族元素,a、d分别是A、D元素对应的单质,m、n、p、q是由这些元素中的部分元素组成的化合物,气体p常作果实催熟剂,m、n为两种常见的液体。上述物质发生的转化关系如下图所示(反应条件已略去)。下列说法错误的是
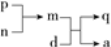
A.原子半径由大到小的顺序为:D>B>C>A
B.简单氢化物的沸点:B<C
C.d与m反应的现象为浮在液面上四处游动
D.C与D形成的化合物中一定含有离子键
难度: 简单查看答案及解析
-
2019年11月《Science》杂志报道了王浩天教授团队发明的制取H2O2的绿色方法,原理如图所示(已知:H2O2
H+ + HO2-,Ka=2.4×10-12)。下列说法错误的是
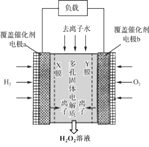
A.a极的电势低于b极
B.Y膜为选择性阴离子交换膜
C.每转移0.4 mol e-,就有0.1 mol H2O2生成
D.b极的电极反应为O2 + 2e- + H2O = HO2- + OH-
难度: 中等查看答案及解析
-
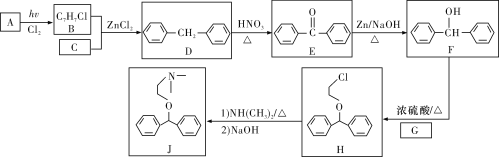
下列关于有机化合物的叙述正确的是( )
A. 已知氟利昂12的结构式为
,该分子是平面形分子
B. 1mol苹果酸[HOOCCH(OH)CH2COOH]可与3molNaHCO3发生反应
C. 用甲苯分别制取TNT、邻溴甲苯所涉及的反应均为取代反应
D.
的一氯代物共有5种(不考虑立体异构)
难度: 中等查看答案及解析
-
在25℃时,将1.0Lc mol·L-1 CH3COOH溶液与0.1mol NaOH固体混合,使之充分反应。然后向该混合溶液中通入HCl气体或加入NaOH固体(忽略体积和温度变化),溶液pH随通入(或加入)物质的物质的量的变化如图所示。下列叙述错误的是( )
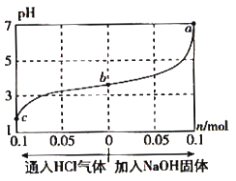
A.水的电离程度:a>b>c
B.b点对应的混合溶液中:c(Na+)<c(CH3COO-)
C.c点对应的混合溶液中:c(CH3COOH)>c(Na+)>c(OH-)
D.该温度下,a、b、c三点CH3COOH的电离平衡常数均为
难度: 中等查看答案及解析