-
下列属于强电解质的是
A. 硫酸钡 B. 食盐水 C. 二氧化硅 D. 醋酸
难度: 简单查看答案及解析
-
酒后驾车是引发交通事故的重要原因。交警对驾驶员进行呼气酒精检测的原理是:橙色的K2Cr2O7酸性水溶液遇乙醇迅速生成蓝绿色Cr3+。下列对乙醇的描述与此测定原理有关的是
①乙醇沸点低 ②乙醇密度比水小 ③乙醇有还原性 ④乙醇是烃的含氧化合物
A. ②④ B. ②③ C. ①③ D. ①④
难度: 简单查看答案及解析
-
化学与生产、生活密切相关。下列叙述正确的是( )
A.煤的干馏、煤的液化和石油的分馏均属化学变化
B.液化石油气和天然气的主要成分都是甲烷
C.裂化汽油和直馏汽油都可以萃取溴水中的Br2
D.用浸泡过高锰酸钾溶液的硅藻土吸收水果释放的乙烯,可到达水果保鲜的目的
难度: 中等查看答案及解析
-
下列说法不正确的是( )
A.“硝基苯制备”实验中,将温度计插入水浴,但水银球不能与烧杯底部和烧杯壁接触
B.“中和滴定”实验中,容量瓶和锥形瓶用蒸馏水洗净后即可使用,滴定管和移液管用蒸馏水洗净后,必须干燥或润洗后方可使用
C.实验时手指不小心沾上苯酚,立即用70℃以上的热水清洗
D.除去干燥CO2中混有的少量SO2,可将混合气体依次通过盛有酸性KMnO4溶液、浓硫酸的洗气瓶
难度: 简单查看答案及解析
-
下列有机物命名正确的是 ( )
A.
2-乙基丙烷 B.CH3CH2CH2CH2OH 1-丁醇
C.
间二甲苯 D.
2—甲基—2—丙烯
难度: 中等查看答案及解析
-
下列烷烃在光照下与氯气反应,只生成一种一氯代烃的是( )
A.
B.
C.
D.
难度: 简单查看答案及解析
-
用石墨作电极电解CuSO4溶液,通电一段时间后,欲使电解液恢复到起始状态,应向溶液中加入适量的 ( )
A.CuSO4 B.H2O C.CuO D.CuSO4·5H2O
难度: 简单查看答案及解析
-
对滴有酚酞试液的下列溶液,操作后颜色变深的是
A.明矾溶液加热 B.CH3COONa溶液加热
C.氨水中加入少量NH4Cl固体 D.小苏打溶液中加入少量NaCl固体
难度: 中等查看答案及解析
-
下列叙述错误的是
A.用金属钠可区分乙醇和乙醚
B.用高锰酸钾酸性溶液可区分己烷和3-己烯
C.用水可区分苯和溴苯
D.用新制的银氨溶液可区分甲酸甲酯和乙醛
难度: 中等查看答案及解析
-
据报道,科学家开发出了利用太阳能分解水的新型催化剂。下列有关水分解过程的能量变化示意图正确的是
A.
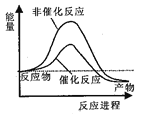 B.
B.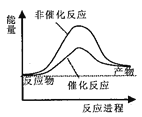
C.
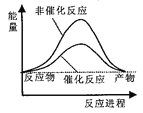 D.
D.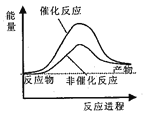
难度: 简单查看答案及解析
-
25℃时,在含有Pb2+、Sn2+的某溶液中,加入过量金属锡(
),发生反应:
,体系中c(Pb2+)和c(Sn2)变化关系如右图所示。下列判断正确的是
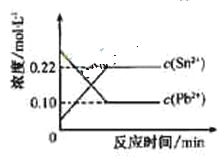
A.往平衡体系中加入少量金属铅后,c(Pb2+)增大
B.往平衡体系中加入少量
固体后,c(Sn2-)变小
C.升高温度,平衡体系中c(Pb2+)增大,说明该反应
D.25℃时,该反应的平衡常数K=2.2
难度: 中等查看答案及解析
-
1-丁醇和乙酸在浓硫酸作用下,通过酯化反应制得乙酸丁酯反应温度为115~125℃,反应装置如下图。下列对该实验的描述错误的是( )
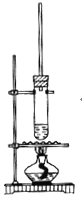
A.不能用水浴加热
B.长玻璃管起冷凝回流作用
C.提纯乙酸丁酯需要经过水、氢氧化钠溶液洗涤
D.加入过量乙酸可以提高1-丁醇的转化率
难度: 中等查看答案及解析
-
从甜橙的芳香油中可分离得到如下结构的化合物:
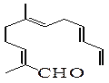
现有试剂:①KMnO4酸性溶液;②H2/Ni;③Ag(NH3)2OH;④新制Cu(OH)2,能与该化合物中所有官能团都发生反应的试剂有
A.①② B.②③ C.③④ D.①④
难度: 简单查看答案及解析
-
化学电源在日常生活和高科技领域中都有广泛应用。下列说法不正确的是
A.
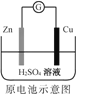 Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加
Zn2+向Cu电极方向移动,Cu电极附近溶液中H+浓度增加B.
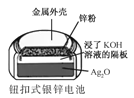 正极的电极反应式为Ag2O+2e−+H2O2Ag+2OH−
正极的电极反应式为Ag2O+2e−+H2O2Ag+2OH−C.
 锌筒作负极,发生氧化反应,锌筒会变薄
锌筒作负极,发生氧化反应,锌筒会变薄D.
 使用一段时间后,电解质溶液的酸性减弱,导电能力下降
使用一段时间后,电解质溶液的酸性减弱,导电能力下降难度: 困难查看答案及解析
-
NaOH溶液滴定邻苯二甲酸氢钾(邻苯二甲酸H2A的Ka1=1.1×10−3 ,Ka2=3.9×10−6)溶液,混合溶液的相对导电能力变化曲线如图所示,其中b点为反应终点。下列叙述错误的是
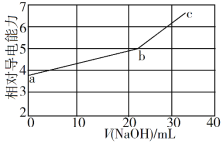
A. 混合溶液的导电能力与离子浓度和种类有关
B. Na+与A2−的导电能力之和大于HA−的
C. b点的混合溶液pH=7
D. c点的混合溶液中,c(Na+)>c(K+)>c(OH−)
难度: 中等查看答案及解析
-
从某含Br—废水中提取Br2的过程包括:过滤、氧化、萃取(需选择合适萃取剂)及蒸馏等步骤。已知:
物质
Br2
CCl4
正十二烷
密度/g·cm-3
3.119
1.595
0.753
沸点/℃
58.76
76.8
215~217
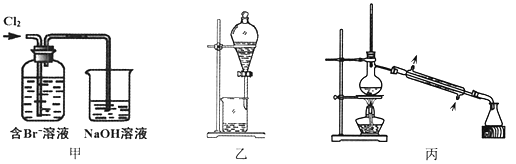
下列说法不正确的是
A.甲装置中Br—发生的反应为:2Br-+ Cl2 = Br2 + 2Cl-
B.甲装置中NaOH溶液每吸收0.1mol Cl2,转移0.1mol e—
C.用乙装置进行萃取,溶解Br2的有机层在下层
D.用丙装置进行蒸馏,先收集到的是Br2
难度: 中等查看答案及解析
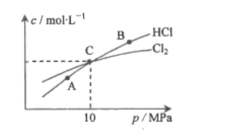
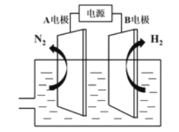
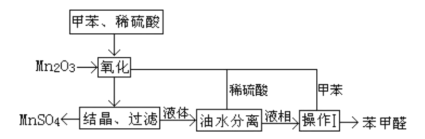
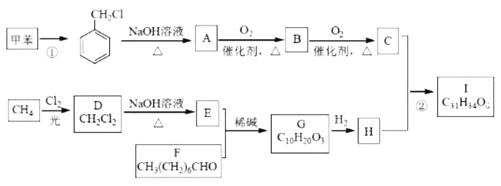
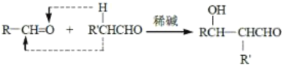 、
、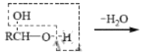 RCHO
RCHO