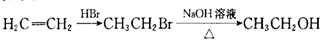-
化学在生产、生活中有着广泛的应用。下列做法正确的是
A.农作物收获后,就地焚烧秸秆,增加土壤中钾肥含量
B.回收制革工厂的边角皮料生产食用明胶,加工成医用胶囊或做食品增稠剂
C.将工业废水“再生”处理,用于城市道路保洁、喷泉和浇花用水
D.食品加工时,尽可能多的使用各种色素、香味剂等添加剂,改善食品的品质
难度: 简单查看答案及解析
-
下列化学用语正确的是
A.聚丙烯的结构简式:
B.甲醛的电子式:
C.铵根离子的结构式:
D.甲酸甲酯的实验式: CH2O
难度: 简单查看答案及解析
-
下列有关物质的性质或应用的说法正确的是
A.钠属于活泼金属,可用电解NaCl溶液的方法获得金属钠
B.FeCl3具有氧化性,可用于工业铜电路板的刻蚀
C.Cl2和SO2都具有漂白性,故可以使NaOH、酚酞混合液褪色
D.浓硫酸具有脱水性,因此实验室可用浓硫酸与浓盐酸制取少量HCl气体
难度: 简单查看答案及解析
-
常温下,下列各组离子在指定的溶液中一定能大量共存的是
A.澄清透明的溶液中:Cu2+、Fe3+、SO42—、I—
B.滴入甲基橙溶液呈红色的溶液中:NH4+、Al3+、HSO3—、NO3—
C.1.0 mol·L-1的KNO3溶液中:NH4+、Fe2+、Cl-、SO42-
D.能溶解Al2O3的溶液中:Mg2+、Fe3+、AlO2—、HCO3—
难度: 简单查看答案及解析
-
短周期元素X、Y、Z、W、Q在周期表中的位置如图所示。下列说法中不正确的是
X
Y
Z
W
Q
A.工业上获得Y、Q单质的方法通常是用电解法
B.形成简单离子的半径从小到大的顺序是:r(Y)< r(Q)< r(W)
C.Z的最高价氧化物可溶于水,也能溶于强碱溶液
D.X的气态氢化物浓溶液可用于检验管道氯气的泄漏
难度: 简单查看答案及解析
-
下列表示对应化学反应的离子方程式正确的是
A.次氯酸钠溶液中加入双氧水有氧气放出:ClO—+ H2O2=O2↑+ Cl—+ H2O
B.碳酸钙溶于稀醋酸溶液:CaCO3+ 2H+= Ca2+ + CO2↑+ H2O
C.用稀硝酸洗涤做过银镜反应的试管:Ag + 4H+ +NO3—= Ag+ + NO↑+2H2O
D.苯酚钠溶液中通入少量CO2:2
+ CO2 + H2O → 2
+ CO32-
难度: 简单查看答案及解析
-
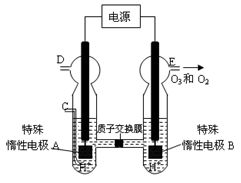
下列有关实验原理或实验操作正确的是
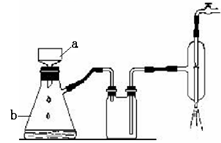
A.用图1从食盐水中分离出氯化钠晶体
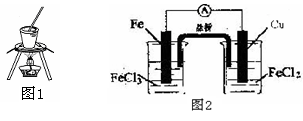
B.通过图2装置实现化学反应:Cu +2Fe3+ =Cu2+ + 2Fe2+
C.实验室可用硝酸铵和消石灰混合加热制取氨气
D.同浓度的碳酸钠、碳酸氢钠溶液,可滴加酚酞进行鉴别
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是
A.25℃,1LpH=1的硫酸溶液中含有的H+数目为0.2NA
B.7.8g Na2S 和Na2O2的混合物中,含有的阴离子数目为0.1 NA
C.足量的Cu与含有0.2mol H2SO4的浓硫酸共热可生成SO2 为0.1 NA
D.标准状况下,2.24LCl2与足量的NaOH溶液反应,转移的电子数目为0.2NA
难度: 简单查看答案及解析
-
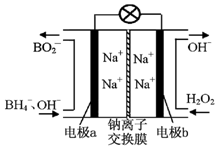
美国普度大学研究开发出一种利用铝镓合金制备氢气的新工艺(工业流程如下所示)。下列有关该工艺的说法错误的是
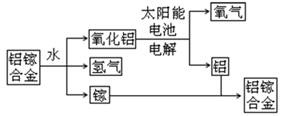
A.该过程能量转化的形式只有两种
B.铝镓合金可以循环使用
C.铝镓合金与水的反应属于置换反应
D.总反应式为:2H2O = 2H2↑+ O2↑
难度: 简单查看答案及解析
-
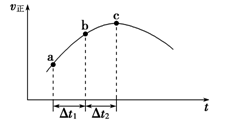
下列图示与对应叙述相符的是
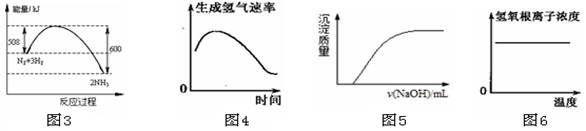
A.图3反应达到平衡后,升高温度,平衡常数K值变大
B.图4表示镁条放入盐酸中生成氢气速率随时间的变化
C.图5表示向Ca(HCO3)2溶液中滴入NaOH溶液所得沉淀的质量的变化
D.图6表示纯碱溶液受热时氢氧根浓度随温度的变化
难度: 简单查看答案及解析
-
莱克多巴胺可作为一种新型瘦肉精使用。自2011年12月5日起在中国境内禁止生产和销售。下列有关莱克多巴胺说法中正确的是
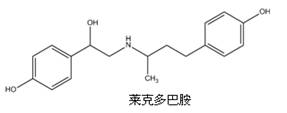
A.分子式为C18H24NO3
B.在一定条件下可发生加成、取代、消去、氧化等反应
C.分子中有2个手性碳原子,且所有碳原子不可能共平面
D.1mol 莱克多巴胺最多可以消耗4 moBr2、3mol NaOH
难度: 简单查看答案及解析
-
下列说法正确的是
A.在300℃、70MPa下由二氧化碳和氢气合成乙醇已成为现实。2CO2(g)+6H2(g)
CH3CH2OH(g)+3H2O(g),则可推测该反应是吸热反应
B.锅炉中沉积的CaSO4可用Na2CO3溶液浸泡后再用酸溶解去除
C.室温下,将浓度为0.1mol.L‾1HF溶液加水稀释,其电离平衡常数和c(H+)/c(HF)均不变
D.电解精练铜时,阳极泥中常含有金属金、银、锌等。
难度: 简单查看答案及解析
-
下列有关实验原理、方法和 结论都正确的是
A.向某溶液中加入盐酸酸化的氯化钡溶液,有白色沉淀生成,该溶液中不一定含有SO42-
B.向蛋白质溶液中加入硫酸铜溶液,将得到的沉淀分离出来,再加水可重新溶解。
C.等体积的PH都为3的酸HA和HB分别与足量的Mg反应,HA放出的H2多,说明酸性:HA>HB
D.淀粉在稀硫酸的作用下水解后,加入氢氧化钠使溶液呈碱性,再加入新制Cu(OH)2后加热,若有砖红色沉淀生成,则淀粉已经完全水解。
难度: 简单查看答案及解析
-
某溶液中仅含有Na+、H+、OH—、CH3COO-四种离子,下列说法错误的是
A.若溶液中离子间满足:c(CH3COO—)=c(Na+)则该溶液一定呈中性
B.该溶液中一定满足: c(CH3COO—)>c(CH3COOH)>c(OH—)>c(H+)
C.溶液中四种离子之间可能满足:c(Na+)>c(OH-)>c(CH3COO—)>c(H+)
D.若溶液中的溶质是CH3COONa和CH3COOH,则溶液中离子间一定满足:
c(CH3COO—)>c(Na+)>c(H+)>c(OH—)
难度: 简单查看答案及解析
-
在温度相同的3个密闭容器中,按不同方式投入反应物,保持恒温、恒容,测得反应达到平衡时的有关数据如下(已知CO(g)+2H2(g)
CH3OH(g) ΔH=-90.7 kJ/mol):
容器
甲
乙
丙
反应物投入量
1 mol CO、2 mol H2
1 mol CH3OH
2 mol CH3OH
CH3OH的浓度(mol/L)
c1
c2
c3
反应的能量变化
放出a kJ
吸收b kJ
吸收c kJ
平衡时压强(Pa)
P1
P2
P3
反应物转化率
α1
α2
α3
下列说法不正确的是
A.c1=c3 B.a+c/2<90.7 C.2P2>P3 D.α1+α3=1
难度: 简单查看答案及解析
 ,写出以乙醇和
,写出以乙醇和