-
某同学在实验室探究NaHCO3的性质:常温下,配制0.10 mol/L NaHCO3溶液,测其pH为8.4;取少量该溶液滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出。下列说法不正确的是
A.NaHCO3溶液呈碱性的原因是HCO3—的水解程度大于电离程度
B.加入CaCl2促进了HCO3—的水解
C.反应的离子方程式是2HCO3—+Ca2+=CaCO3↓+H2CO3
D.反应后的溶液中存在:c(Na+)+2c(Ca2+)=c(HCO3—)+2c(CO32—)+c(Cl-)
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、M、N的原子序数依次增大。X和M的原子核外最外层电子数是周期数的二倍,Y、Z、M最高价氧化物对应的水化物两两之间能相互反应。下列叙述正确的是
A.元素非金属性由弱到强的顺序:M、N、X
B.原子最外层电子数由少到多的顺序:Y、Z、X、M、N
C.电解熔融的N和Z形成的化合物可得到对应的N和Z的单质
D.单质Y的熔点高于单质Z的熔点
难度: 中等查看答案及解析
-
下列说法正确的是
A. 生物柴油的主要成分是液态烃
B. 尽管人体内不含消化纤维素的酶,但纤维素在人类食物中也是必不可缺少的
C. 糖类又称为碳水化合物,均可用通式Cn(H2O)m 表示
D. 淀粉的糊化作用和鸡蛋清中滴加饱和Na2SO4 溶液出现沉淀的现象均属于化学变化
难度: 中等查看答案及解析
-
NA表示阿伏加德罗常数的值。下列说法正确的是
A.2.0gCO2与SO2的混合气体分子中,含有的质子数为NA
B.7.1gCl2与100mL1.0mol·L-1NaOH溶液反应,转移电子数为0.1NA
C.17gNH3与48gO2在催化剂作用下充分反应,得到NO分子数为NA
D.标准状况下,2.24LCH4和C3H6混合气体中,含有极性键数为0.5NA
难度: 中等查看答案及解析
-
有机物TPE具有聚集诱导发光特性,在光电材料领域应用前景广阔,其结构简式如下图所示。下列有关该有机物说法正确的是( )

A. 分子式为C26H22 B. 属于苯的同系物
C. 一氯代物有3种 D. 能溶于水和酒精
难度: 中等查看答案及解析
-
过氧化钙晶体(CaO2·8H2O)常用作医药消毒剂,可以轻质碳酸钙为原料,按以下实验方法来制备。
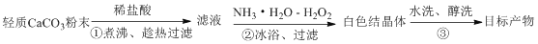
下列有关说法正确的是
A. ①煮沸的主要目的是为了除去溶解的CO2
B. ②的反应中H2O2作氧化剂,氨水用来调节溶液的pH
C. ②中结晶的颗粒较小,过滤时可用玻璃棒轻轻搅动
D. ③醇洗的主要目的是为了减少晶体的损失
难度: 中等查看答案及解析
-
利用如图所示的电化学装置处理工业尾气中的硫化氢可实现硫元素的回收。下列说法中正确的是
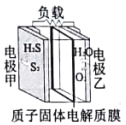
A. 电池工作时电子由电势高的电极甲经负载向电势低的电极乙移动
B. 电池工作一段时间后,理论上消耗O2和H2S的体积相等
C. 当有1molH2S参与反应,则有2molH+由负极区进入正极区
D. 电极甲上的电极反应为:2H2S+4OH――4e-=S2+4H2O
难度: 中等查看答案及解析

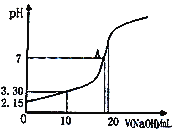
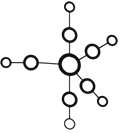
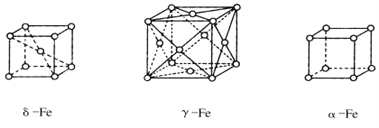
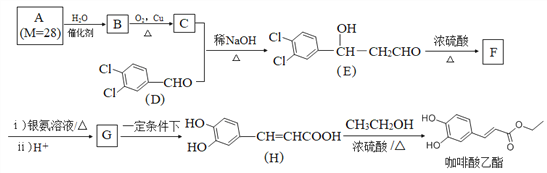
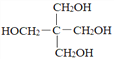 )的路线(无机试剂任任选)。________________________
)的路线(无机试剂任任选)。________________________