-
某同学在实验室探究NaHCO3的性质:常温下,配制0.10 mol/L NaHCO3溶液,测其pH为8.4;取少量该溶液滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出。下列说法不正确的是
A.NaHCO3溶液呈碱性的原因是HCO3—的水解程度大于电离程度
B.加入CaCl2促进了HCO3—的水解
C.反应的离子方程式是2HCO3—+Ca2+=CaCO3↓+H2CO3
D.反应后的溶液中存在:c(Na+)+2c(Ca2+)=c(HCO3—)+2c(CO32—)+c(Cl-)
高二化学单选题中等难度题查看答案及解析
-
某同学在实验室探究NaHCO3的性质:常温下,配制0.10mol•L-1NaHCO3溶液,测其pH为8.4;取少量该溶液滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出。下列说法不正确的是
A.NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度
B.加入CaCl2促进了HCO3-的电离
C.反应的离子方程式是2HCO3-+Ca2+═CaCO3↓+H2CO3
D.反应后的溶液中存在:c(Na+)+2c(Ca2+)=c(HCO3-)+2c(CO32-)+c(Cl-)+c(H2CO3)
高二化学选择题中等难度题查看答案及解析
-
某同学探究NaHCO3的性质,部分实验报吿记录如下:
① 常温下,配制0.10 moI/L NaHCO3溶液,测其pH为8.4;
② 取少量该溶液于试管中,向其中滴加CaCl2溶液至中性,滴加过程中只产生一种白色沉淀(能与盐酸作用产生气体),但无气体放出。
下列说法不正确的是
A. NaHCO3溶液呈碱性的原因是HCO3-的水解程度大于电离程度
B. 加入CaCl2促进了HCO3-的水解
C. 反应的离子方程式是2HCO3-+Ca2+=CaCO3↓+ H2CO3
D. 反应后的溶液中存在:c(Na+)+ 2c(Ca2+)=c(HCO3-)+2c(CO32-) +c(Cl-)、
高二化学单选题困难题查看答案及解析
-
为了证明醋酸是弱电解质,某同学开展了题为“醋酸是弱电解质的实验探究”的探究活动。该同学设计了如下方案,其中错误的是( )
A.先配制0.10 mol/L CH3COOH溶液,再测溶液的pH,若pH大于1,则可证明醋酸为弱电解质
B.先配制0.01 mol/L和0.10 mol/L的CH3COOH,再分别用pH计测它们的pH,若两者的pH相差小于1个单位,则可证明醋酸是弱电解质
C.取等体积、等pH的CH3COOH的溶液和盐酸分别与足量锌反应,测得反应过程中醋酸产生H2速率较慢且最终产生H2较多,则可证明醋酸为弱电解质
D.配制一定量的CH3COONa溶液,测其pH,若常温下pH大于7,则可证明醋酸是弱电解质
高二化学单选题中等难度题查看答案及解析
-
下列实验操作及现象结论描述不准确的是( )
A.向沸水中滴加饱和氯化铁溶液制备胶体,用可见光束照射,产生丁达尔效应
B.常温下,向0.10mol·L-1 NaHCO3溶液,滴加CaCl2溶液至pH=7,滴加过程中产生白色沉淀,但无气体放出,说明加入CaCl2促进了HCO3-的水解
C.利用以下实验器材(规格数量不限):烧杯、量筒、环形玻璃搅拌棒、纸条、硬纸板、温度计能完成中和反应反应热的测定
D.向浓度均为0.1mol·L-1的MgCl2、CuCl2混合溶液中逐滴加入氨水,先出现蓝色沉淀,因为KSP[Mg(OH)2]>KSP[Cu(OH)2]
高二化学选择题中等难度题查看答案及解析
-
下列有关实验的说法正确的是

A.加热后溶液颜色变为无色 B.配制100 mL 0.10 mol·L-1NaCl溶液
C.实验室用该装置制取少量蒸馏水 D.称量25 g NaOH
高二化学选择题困难题查看答案及解析
-
下列有关实验的说法正确的是


A B C D
A.加热后溶液颜色变为无色 B.配制100 mL 0.10 mol·L-1NaCl溶液
C.实验室用该装置制取少量蒸馏水 D.称量25 g NaOH
高二化学选择题中等难度题查看答案及解析
-
下列有关实验操作或原理正确的是
甲
 乙
乙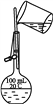 丙
丙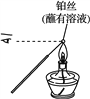 丁
丁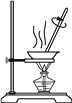
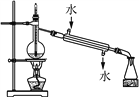
A. 实验室用装置甲可制取少量蒸馏水
B. 乙表示配制100 mL 0.10 mol·L-1 NaCl溶液时转移溶液
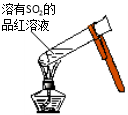
C. 丙中操作是通过焰色反应检验样品中是否含有K+
D. 装置丁用于蒸发NH4Cl溶液得到NH4Cl晶体
高二化学null中等难度题查看答案及解析
-
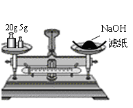
某实验小组配制0.10mol/LNaOH溶液并进行有关性质实验,回答下列问题。
(1)若实验中大约要使用475mLNaOH溶液,至少需要称量NaOH固体______g。
(2)从下图中选择称量NaOH固体所需要的仪器是(填字母)____________。在配制溶液时,当快到达刻度线时如何进行定容操作_____________________。名称
托盘天平
(带砝码)
小烧杯
坩埚钳
玻璃棒
药匙
量筒
仪器

序号
a
b
c
d
e
f
(3)下列情况会使所配溶液浓度偏低的是(填序号) ________________
①称量读数时,左盘高,右盘低
②所用的砝码生锈
③溶液转移到容量瓶后,未进行洗涤操作
④转移溶液前容量瓶内有少量蒸馏水
⑤定容时,仰视容量瓶的刻度线
⑥在烧杯中溶解NaOH后,立即将所得溶液注入容量瓶中
⑦定容后摇匀,发现液面降低,又补加少量水,重新达到刻度实验室欲配制
⑧用量筒量取一定量浓硫酸配制稀硫酸,转移到烧杯后,用少量水洗涤量筒
高二化学综合题中等难度题查看答案及解析
-
下列有关实验操作或原理正确的是

A B C D
A. 实验室用该装置可制取少量蒸馏水
B. 配制100 mL 0.10 mol·L—1NaCl溶液时转移溶液
C. 通过焰色反应检验样品中是否含有K+
D. 蒸发NH4Cl溶液得到NH4Cl晶体
高二化学选择题中等难度题查看答案及解析