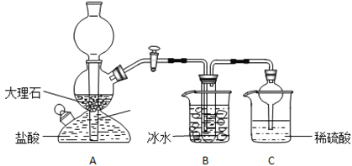
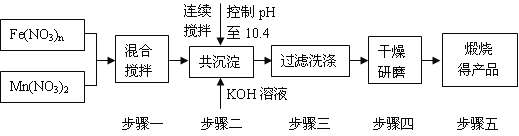
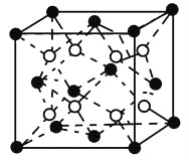
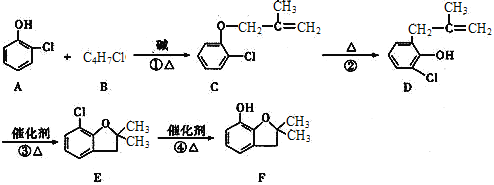
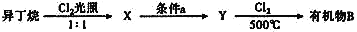-
《汉书》中“高奴县有洧水可燃”,沈括在《梦溪笔谈》对“洧水”的使用有“予知其烟可用,试扫其烟为墨,黑光如漆,松墨不及也,此物必大行于世”的描述,对上文进行的某些分析中正确的是
A.“洧水”的主要成分是油脂
B.“洧水”的主要成分是煤油
C.烟的主要成分是炭黑
D.烟的主要成分是石墨
难度: 简单查看答案及解析
-
甲乙丙是三种不含相同离子的可溶性电解质。他们所含的离子如表所示。取等质量的三种化合物配制相同体积的溶液,其物质的量浓度:c(甲)<c(乙)<c(丙),下列说法正确的是
阳离子
Na+、NH4+、Fe3+
阴离子
OH-、Cl-、SO42-
A.甲中一定含有Na+ B.乙中一定含有NH4+
C.丙中一定含有Fe3+ D.丙中一定含有SO42-
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的数值,下列说法正确的是
A.常温下,23g NO2和N2O4的混合气体含有NA个氧原子
B.1L0.1mol•L-1的氨水含有0.1NA个OH―
C.标准状况下,NO和O2各11.2L混合,所得混合气体的分子总数为0.75NA
D.1molFe与1molCl2充分反应,转移3NA个电子
难度: 中等查看答案及解析
-
下列离子方程式正确的是
A.向稀HNO3中滴加Na2SO3溶液:SO32-+2H+=SO2↑+H2O
B.硫酸亚铁溶液中加入用硫酸酸化的过氧化氢溶液 Fe2++2H++H2O2=Fe3++2H2O
C.Mg(HCO3)2溶液中加入过量石灰水:Mg2++2HCO3-+Ca2++2OH-=CaCO3↓+2H2O+MgCO3↓
D.向含 0.5 mol的FeBr2溶液中通入13.44L(标准状况下)Cl2:10Fe2++14Br-+12Cl2=10Fe3++7Br2+24Cl-
难度: 中等查看答案及解析
-
下列所陈述的事实与解释均正确的是
选项
实验操作及现象
实验结论
A
用pH试纸测定NaClO溶液的酸碱性,试纸显蓝色
NaClO水解显碱性
B
收集铜与浓硝酸反应生成的气体,用冰水混合物冷却降温,气体颜色变浅
生成的红棕色NO2气体部分转化为无色气体
C
向某溶液中加入几滴新制的氯水,再加入2滴KSCN溶液,溶液变为红色
原溶液中一定含有Fe2+
D
甲苯能使酸性高锰酸钾溶液褪色
发生了萃取
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
乙酸橙花酯是一种食用香料,其结构简式如图,关于该有机物的叙述中正确的是( )
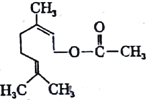
①1mol该有机物可消耗3molH2;②不能发生银镜反应;③分子式为C12H20O2;④它的同分异构体中可能有酚类;⑤1mol该有机物水解时只能消耗1molNaOH
A.②③⑤ B.①④⑤ C.①②③ D.②③④
难度: 中等查看答案及解析
-
天津危险品仓库起火引发爆炸,产生的CN-污染可用右图所示装置除去含CN-废水中的CN-,控制溶液pH为9~10并加入食盐,阳极产生的ClO-将CN-氧化为两种无污染的气体,下列说法不正确的是
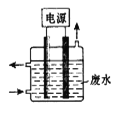
A.用石墨作阳极,铁作阴极
B.阳极的电极反应式为:Cl- + 2OH--2e-= ClO- + H2O
C.阴极的电极反应式为:2H2O + 2e- = H2↑ + 2OH-
D.除去CN-的反应:2CN-+ 5ClO- + 2H+ = N2↑ + 2CO2↑ + 5Cl-+ H2O
难度: 中等查看答案及解析