-
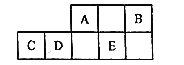
下列叙述Ⅱ对叙述Ⅰ解读错误的是( )
选项
叙述Ⅰ
叙述Ⅱ
A
新中国第一根光导纤维
光纤的主要成分是SiO2
B
港珠澳大桥的钢柱与电源的负极连接
采用牺牲阳极的阴极保护法
C
国庆70周年晚会上有文艺表演和焰火表演
“焰火”包含“焰色反应”
D
谚语“雷雨肥庄稼”的原理是氮的自然固定
N2转化成作物能吸收的氮素
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
化学在生产、生活中有广泛应用。下列说法正确的是( )
A.食品袋和粮仓里充入氮气作防腐剂
B.75%酒精常作水壶的除垢剂
C.明矾常作饮用水的消毒剂
D.生理盐水常作餐具的除污剂
难度: 中等查看答案及解析
-
下列化学用语正确的是( )
A.BF3的电子式为:
B.干冰分子的结构式为CO2
C.质量数为40的氯原子为
Ar
D.丙烯酸甲酯的结构简式为CH2=CHCOOCH3
难度: 中等查看答案及解析
-
NA是阿伏伽德罗常数的值。下列说法错误的是( )
A.常温常压下,40gSO3含原子总数为2NA
B.1mol铜锌合金与足量稀硝酸反应转移电子数为2NA
C.1L1mol•L-1CH3COONH4中性溶液含NH4+数目为NA
D.1mol
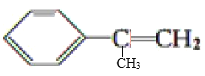 分子中最多共平面的碳原子数为9NA
分子中最多共平面的碳原子数为9NA难度: 中等查看答案及解析
-
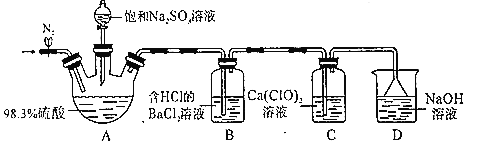
双氟磺酰亚胺锂[LiN(SO2F)2]是具有广泛应用前景的电解质溶液,氮化锂(Li3N)是合成它的原料之一,氮化锂遇水剧烈反应。实验室用饱和NH4Cl溶液和NaNO2溶液共热制N2,N2和锂在加热条件下反应生成氮化锂。某小组设计下列装置制备Li3N。下列说法正确的是( )
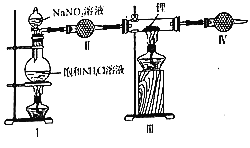
A.装置Ⅱ中盛装无水硫酸铜,检验氮气中水蒸气
B.实验时,先点燃Ⅰ处酒精灯,后点燃Ⅲ处酒精灯
C.装置Ⅳ的作用是吸收尾气,避免污染环境
D.若Li3N产品含少量Li,利用与水反应生成气体的量测其纯度会偏低
难度: 中等查看答案及解析
-
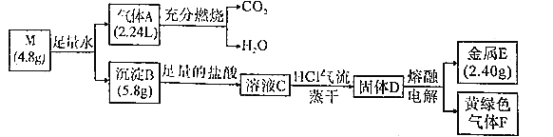
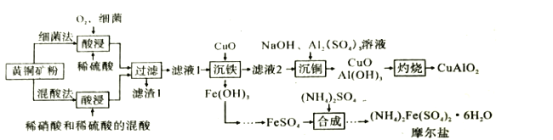
工业上,常用黄铜矿(主要成分为CuFeS2,其中铁为+2价)提取FeSO4和Cu。主要反应:4CuFeS2+17O2+2H2SO4=4CuSO4+2Fe2(SO4)3+2H2O。下列有关说法错误的是( )
A.氧化产物中含有Cu2+、Fe3+和所有SO42-
B.用K3[Fe(CN)6]溶液检验溶液是否含Fe2+
C.每生成1molFe2(SO4)3必转移34mol电子
D.若设计成原电池,负极附近溶液pH降低
难度: 中等查看答案及解析
-
AgI可用于人工降雨。AgI溶于水,溶液中离子浓度与温度的关系如图所示,已知:pAg=-lgc(Ag+),pI=-lgc(I-)。下列说法正确的是( )
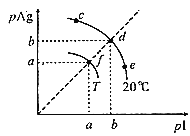
A.图象中,T<20℃
B.AgI的溶度积Ksp(AgI):c=d=e<f
C.20℃时,AgI粉末溶于饱和KI溶液中c(Ag+)=1×10-bmol•L-1
D.在d点饱和AgI溶液中加AgNO3粉末,d点移动到f点
难度: 中等查看答案及解析
-
香料H的结构简式如图所示,下列说法错误的是( )
A.H能发生取代反应和加成反应
B.H含有两种官能团
C.H水解产物之一能被氧化成羧酸
D.H的分子式为C13H22O3
难度: 中等查看答案及解析
-
下列离子组能大量共存且加入(或通入)少量试剂发生的离子反应方程式正确的是( )
选项
离子组
试剂
离子方程式
A
无色溶液中:Na+、NH4+、S2-、SO32-
盐酸
S2-+SO32-+6H+═2S↓+3H2O
B
新制氯水中:Ba2+、Fe3+、Cl-、NO3-
KI
Cl2+2I-═I2+2Cl-
C
25℃水电离c水(H+)·c水(OH-)=1×10-20的水溶液中:Na+、K+、Cl-、HCO3-
NaOH
HCO3-+OH-═CO32-+H2O
D
NaHCO3溶液中:Al3+、Mg2+、SO42-、Cl-
BaCl2
Ba2++SO42-═BaSO4↓
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
短周期主族元素R、X、Y、Z的原子序数依次增大,Y、Z原子最外层电子数之和等于X原子最外层电子数的2倍,R和Y位于同主族。R、X和Z构成一种分子的结构式如图所示,下列说法错误的是( )
A.原子半径:Y>Z>X>R
B.YR和YZ都是离子化合物
C.Z的氧化物对应的水化物是强酸
D.常温常压下,X的氢化物可能呈液态
难度: 中等查看答案及解析
-
下列实验操作、现象和结论都正确且它们之间有相关性的是( )
选项
操作
现象
结论
A
分别测定浓度相同的NaX、NaY溶液的pH
pH前者较大
电离常数:HX>HY
B
在Fe(NO3)2溶液中滴加盐酸
溶液变黄色并产生气泡
HNO3易分解
C
向某溶液中通入CO2
产生白色沉淀
原溶液一定含SiO32-
D
在酸化的KMnO4溶液中滴加葡萄糖溶液
紫红色溶液变无色溶液
葡萄糖具有还原性
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某常见金属的结晶水化合物MCl3·6H2O有如下转化关系:下列推断正确的是( )
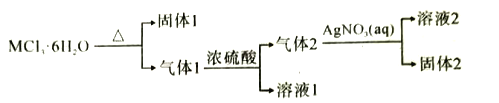
A.固体1一定是既能与盐酸反应,又能与强碱反应
B.气体1通过五水硫酸铜晶体,固体变蓝色
C.常温下,溶液2能溶解铜
D.固体2浊液中滴加Na2S溶液,白色固体变黄色
难度: 中等查看答案及解析
-
下列有关有机物的说法正确的是( )
A.苯、溴化铁和溴水混合可以制备溴苯
B.CH2=C(CH3)COOCH3通过缩聚反应合成有机玻璃
C.苯乙烯能分别使溴的四氯化碳溶液、酸性高锰酸钾溶液褪色且原理相同
D.能与NaOH溶液反应的有机物(C4H8O2)共有6种同分异构体
难度: 中等查看答案及解析
-
钼及其合金在冶金、电器等方面有广泛应用。在1L恒容密闭容器中充入足量的Na2CO3、MoS2和H2,发生反应:MoS2(s)+2Na2CO3(s)+4H2(g)⇌Mo(s)+2CO(g)+4H2O(g)+2Na2S(s) △H,测得在不同温度下H2的物质的量与时间关系数据如表所示:下列说法错误的是( )
min
mol
K
0
10
20
30
40
T1
2
1.6
1.3
1.0
1.0
T2
2
1.2
1.0
n
0.6
A.T2>T1,△H<0
B.表格中n=0.6
C.T2K下20min时,v正>v逆
D.T1K下平衡常数K=0.25(mol•L-1)2
难度: 中等查看答案及解析
-
某废水中含有Mg2+、NH4+、Na+、SO42-和NO3-,某工厂采用电渗析法处理废水获得化工品。模拟装置如图所示(废水进、出口省略)。下列说法正确的是( )
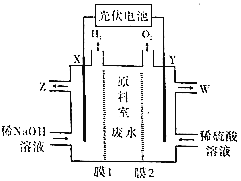
A.膜1交换阴离子,膜2交换阳离子
B.理论上交换的阳离子与阴离子数目相同
C.X极的反应式为2H2O+2e-═2OH-+H2↑
D.W处流出的溶液含1种溶质
难度: 中等查看答案及解析
-
常温下,向20mL0.1mol•L-1Na2X溶液中缓慢滴加0.1mol•L-1盐酸溶液(不逸出H2X),溶液pH与溶液中lg
之间关系如图所示。下列说法错误的是( )
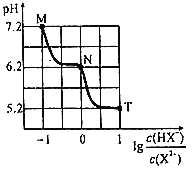
A.M点:c(X2-)>c(HX-)>c(OH-)>c(H+)
B.常温下,0.1molNa2X和1molNaHX同时溶于水得到溶液pH=5.2
C.N点:c(Na+)<3c(X2-)+c(Cl-)
D.常温下,X2-第一步水解常数Kh1的数量级为10-8
难度: 中等查看答案及解析