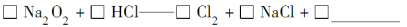-
某小组设计实验探究SO2和漂粉精反应原理,装置如图所示。、
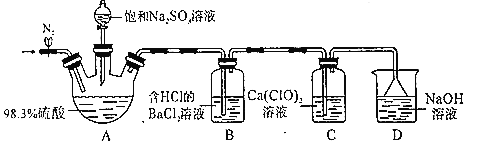
实验操作过程如下:
步骤1:连接装置并检查装置气密性,按如图所示装好药品;
步骤2:打开止水夹,向装置中通入一段时间N2,并关闭止水夹;
步骤3:取下分液漏斗的塞子,旋转活塞,向三颈瓶中滴加饱和Na2SO3溶液。过一会儿,观察到B和C中都产生白色沉淀
步骤4:实验完毕后,检验C中白色固体,白色固体是CaSO4。
回答下列问题:
(1)B装置中盐酸的作用是__;能证明A中产生的“酸雾”含有H2SO4的实验现象是___。
(2)A中硫酸表现出来的性质有__。
(3)步骤2中通入N2的目的是__。
(4)实验完毕后,经检验,D中溶液含有等物质的量浓度的两种还原性盐,写出总反应的离子方程式__。
(5)步骤4检验C中白色沉淀成分的操作是,取少量C中白色固体,滴加足量___(填名称),振荡,白色固体不溶解,则白色固体是CaSO4。
(6)经分析,C中发生化学反应与反应物相对量有关:
若通入少量SO2,则发生反应为3Ca(ClO)2+2SO2+2H2O═2CaSO4↓+4HClO+CaCl2;
若通入过量SO2,则发生反应为Ca(ClO)2+2SO2+2H2O═CaSO4↓+H2SO4+2HCl,SO2+H2O⇌H2SO3。
设计实验证明上述C中通入过量SO2:__。
-
(14分)工业上为了测定辉铜矿(主要成分是Cu2S)中Cu2S的质量分数,设计了如图装置。实验时按如下步骤操作:实验原理是
A.连接全部仪器,使其成为如图装置,并检查装置的气密性。
B.称取研细的辉铜矿样品1.000g。
C. 将称量好的样品小心地放入硬质玻璃管中。
D.以每分钟1L的速率鼓入空气。
E.将硬质玻璃管中的辉铜矿样品加热到一定温度,发生反应为:Cu2S+O2=SO2 +2Cu。
F.移取25.00ml含SO2的水溶液于250ml锥形瓶中,用0.0100mol/L KMnO4标准溶液滴定至终点。按上述操作方法重复滴定2—3次。
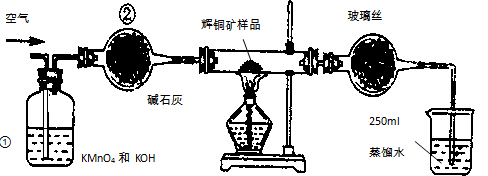
试回答下列问题:
(1)装置①的作用是_________________;装置②的作用是____________________。
(2)假定辉铜矿中的硫全部转化为SO2,并且全部被水吸收,则操作F中所发生反应的化学方程式为
(3)若操作F的滴定结果如下表所示,则辉铜矿样品中Cu2S的质量分数是_________。
| 滴定 次数 | 待测溶液的 体积/mL | 标准溶液的体积 |
| 滴定前刻度/mL | 滴定后刻度/mL |
| 1 | 25.00 | 1.04 | 21.03 |
| 2 | 25.00 | 1.98 | 21.99 |
| 3 | 25.00 | 3.20 | 21.24 |
| | | |
(4)本方案设计中有一个明显的缺陷影响了测定结果(不属于操作失误),你认为是__________(写一种即可)。
(5)已知在常温下FeS 的 Ksp= 6.25 × 10 -18, H2S 饱和溶液中 c (H+)与 c (S2-)之间存在如下关系: c2 (H+) ·c(S2-) = 1.0×10-22 。在该温度下,将适量 FeS 投入硫化氢饱和溶液中,欲使溶液中(Fe2+)为 lmol/L,应调节溶液的c(H十)为__________________。
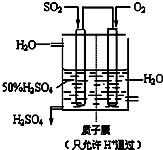
(6)某人设想以下图所示装置用电化学原理生产硫酸,写出通入SO2的电极的电极反应式______.
-
某研究性学习小组,为了探究过氧化钠的强氧化性,设计了如图的实验装置。
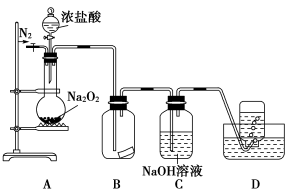
实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,反应剧烈,产生黄绿色气体。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中的湿润的红色纸条褪色,证明A中反应有________(填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因___________________________________________。
(2)装置C的作用是____________________________________________。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为①________;②________。
(4)实验证明,Na2O2能与干燥的HCl反应,完成并配平该化学方程式。
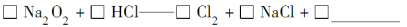
该反应________(填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是____________________________________________(要求答出要点)。
-
(16)为了探究过氧化钠的强氧化性,某研究性学习小组设计了如图所示的实验装置。
实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓
盐酸,剧烈反应,有气体产生。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中湿润的红色纸条退色,证明A中反应有 (填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因 。
(2)装置C的作用是 。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为① ;② 。
(4)实验证明,Na2O2与干燥的HCl能反应,完成并配平该化学方程式。
Na2O2+ HCl=== Cl2+ NaCl+H2O
该反应 (填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是 (要求答出两点)。
-
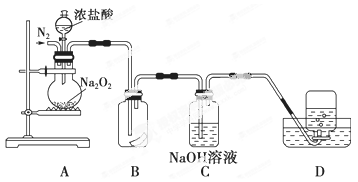
为了探究过氧化钠的强氧化性,某研究性学习小组设计了如图所示的实验装置。
实验步骤及现象如下:
①检查装置气密性后,装入药品并连接仪器。
②缓慢通入一定量的N2后,将装置D连接好(导管末端未伸入集气瓶中),再向圆底烧瓶中缓慢滴加浓盐酸,剧烈反应,有气体产生。
③一段时间后,将导管末端伸入集气瓶中收集气体。装置D中收集到能使带火星的木条复燃的无色气体。
④反应结束后,关闭分液漏斗的活塞,再通入一定量的N2,至装置中气体无色。
回答下列问题:
(1)装置B中湿润的红色纸条退色,证明A中反应有 (填化学式)生成。若B中改放湿润的淀粉KI试纸,仅凭试纸变蓝的现象不能证明上述结论,请用离子方程式说明原因 。
(2)装置C的作用是 。
(3)甲同学认为O2是Na2O2被盐酸中的HCl还原所得。乙同学认为此结论不正确,他可能的理由为① ;② 。
(4)实验证明,Na2O2与干燥的HCl能反应,完成并配平该化学方程式。
 Na2O2+
Na2O2+ HCl=
HCl= Cl2+
Cl2+ NaCl+
NaCl+ 该反应 (填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是 (要求答出两点)。
该反应 (填“能”或“不能”)用于实验室快速制取纯净的Cl2,理由是 (要求答出两点)。
-
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示。
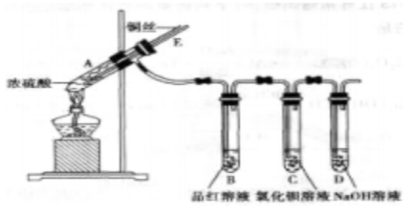
实验步骤:
①先连接好装置,检查气密性,再加入试剂;
②加热A试管,B中品红溶液褪色,熄灭酒精灯;
③将铜丝向上抽动离开液面。
(1)试管中发生反应的化学方程式为_____________________________.
(2)能够证明铜与浓硫酸反应生成气体的现象_________________________.
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其分成两份,分别滴加下列溶液,将产生沉淀的化学式填入下表相应的位置。
| 滴加的溶液 | 氯水 | 氨水 |
| 沉淀的化学式 | __________ | ______________ |
写出其中SO2显示还原性的反应的离子方程式___________________.
(4)实验完毕后,先熄灭酒精灯,由于导管E存在,B中的液体不会倒吸入A中,其原因是___________________________________________.
(5)实验完毕后,装置中残留气体有毒,不能打开胶塞。为了防止该气体排入空气中污染环境,拆除装置前,应当采取的操作是_______________________.
-
碱式碳酸铜可用作木材防腐剂、水体杀藻剂等,研究性学习小组设计以下方案制备碱式碳酸铜并进行相关实验探究。
Ι.以铜屑为原料制备碱式碳酸铜的装置如下:
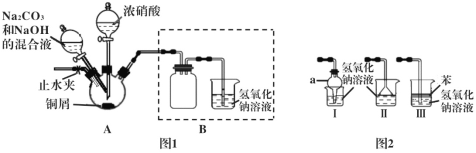
步骤1 连接好装置,检查装置的气密性,装药品。
步骤2 往三颈烧瓶中加入适量的浓硝酸,使铜屑完全反应。
步骤3 往步骤2反应后的溶液中加入一定比例的Na2CO3和NaOH的混合液,加热。
步骤4 将三颈烧瓶中的混合物过滤、洗涤、烘干,获得产物。
已知:ⅰ.碱式碳酸铜为草绿色或绿色结晶物,易溶于酸,不溶于水,在100℃的水中易分解;
ⅱ.NO+NO2+2NaOH=2NaNO2+H2O,2NO2+2NaOH=NaNO3+NaNO2+H2O;
NO不能单独与NaOH溶液反应。
(1)步骤2中浓硝酸与铜屑反应的离子方程式为___________________。
(2)步骤2反应一段时间后,须打开止水夹,通入一段时间的空气,目的是_______。
(3)步骤3对装置A的加热方式最好采用____________。
(4)装置Ι中仪器a的名称为____,Ⅰ、Ⅱ、Ⅲ三个装置不能替代图1中B装置的是_____(填装置序号)。
(5)欲检验步骤4获得的产物中是否含有NO3-,所需的试剂可以是__________。
Ⅱ.探究在一定温度下,不同的原料配比对产物的影响,实验数据如下:
| 实验序号 | V[Cu(NO3)2] /mL (0.5 mo1·L-1) | V(NaOH) / mL (0.5 mo1·L-1) | V(Na2CO3)/ mL (0.25 mo1·L-1) | 沉淀数量 | 沉淀颜色 |
| 1 | 2.0 | 2.0 | 1.6 | + | 浅绿色 |
| 2 | 2.0 | 2.0 | 2.0 | + + | 浅绿色 |
| 3 | 2.0 | 2.0 | 2.4 | + + + | 蓝色 |
| 4 | 2.0 | 2.0 | 2.8 | + + + | 蓝色 |
注:“+”越多表示沉淀量越多
(6)分析表格数据可得:制备碱式碳酸铜最佳的原料配比n[Cu(NO3)2]:n(NaOH) : n(Na2CO3) =___。
Ⅲ.产物组成的测定
(7)碱式碳酸铜的成分有多种,化学式可表示为mCu(OH)2·n CuCO3。为测定Ι中所得碱式碳酸铜的组成,学习小组同学准确称取3.820 g样品溶于适量的硫酸中,加水配成l00 mL溶液,取l0.00 mL溶液于锥形瓶中,加适量水稀释,调节溶液pH至3~4,加入过量的KI(2 Cu2+ + 4 I- = 2 CuI↓ + I2),用0.l000 mol·L-1 Na2S2O3标准溶液滴定(2 S2O32- + I2 = 2I- + S4O62-),接近终点时,加入淀粉指示剂,继续滴定至终点,蓝色消失。进行平行实验后,测得平均消耗Na2S2O3标准溶液的体积为35.00 mL。该碱式碳酸铜的化学式为_____
-
某实验小组同学为了探究铜与浓硫酸的反应,进行了如下实验,实验装置如图所示。
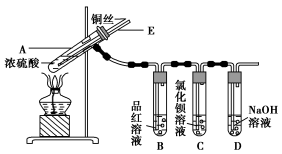
实验步骤:
①先连接如图所示的装置,检查好气密性,再加入试剂;
②加热A试管,待B试管中品红溶液退色后,熄灭酒精灯;
③将Cu丝向上抽动离开液面。
请回答下列问题:
(1)A试管中发生反应的化学方程式为 。
(2)能够证明铜与浓硫酸反应生成气体的实验现象是 。
(3)在盛有BaCl2溶液的C试管中,除了导管口有气泡外,无其他明显现象,若将其中的溶液分成两份,分别滴加下列溶液,将产生沉淀的化学式填入表中对应的位置。
写出其中SO2表现还原性的离子反应方程式: 。
(4)实验完毕后,先熄灭酒精灯,由于导管E的存在,试管B中的液体不会倒吸入试管A中,其原因是 。
(5)实验完毕后,装置中残留的气体有毒,不能打开导管上的胶塞。为了防止该气体排入空气中污染环境,拆除装置前,应当采取的操作是 。
(6)将SO2气体通入含有n mol Na2S的溶液中,充分反应后,溶液中出现黄色浑浊,试分析该溶液最多能吸收SO2气体 mol(不考虑溶解的SO2)。
-
实验题(17分)工业上可用下列仪器组装一套装置来测定黄铁矿中硫的质量分数(忽悠SO2、H2SO3与氧气的反应)。
实验的正确操作步骤如下:
A、连接好装置,并检查装置的气密性
B、称取研细的黄铁矿样品
C、将2.0g样品小心地放入硬质玻璃管中。
D、以1L/min的速率不断鼓入空气。
E、将硬质玻璃管中的黄铁矿样品加热到800℃~850℃。
F、用300ml的饱和碘水吸收SO2 ,发生的反应是:I2+SO2+2H2O=H2SO4+2HI
G、吸收液用CCl4萃取,分离得到上层无色溶液
H、取20.00ml 吸收液,用标准0.2000 mol·L-1的NaOH溶液滴定。(填“上”、“下”)层溶液进行后续实验。
试回答:
(1) 步骤G中所有主要仪器是 、应取
(2)装置⑤的作用是 ;
(3) 装置连接顺序是 (填编号)。
(4) 步骤H中滴定时应选用________作指示剂,可以根据________现象判断滴定已达到终点。
(5) 假定黄铁矿中的硫在操作E中已全部转化为SO2,并全部饱和碘水完全吸收。滴定得到的数据如表所示:
| 滴定次数 | 待测液的体积/mL | 标准溶液NaOH(aq)体积 |
| 滴定前刻度/mL | 滴定后刻度/mL |
| 第一次 | 20.00mL | 0.00 | 20.48 |
| 第二次 | 20.00mL | 0.22 | 22.15 |
| 第三次 | 20.00mL | 0.36 | 20.38 |
则该黄铁矿样品中硫元素的质量分数为 ________。(保留小数点后1位)
-
工业上用空气氧化(NH4)2SO3的方法制取(NH4)2SO4,某研究小组用如图装置模拟该过程,并通过测定反应后溶液中SOT的浓度来计算该反应的转化率。
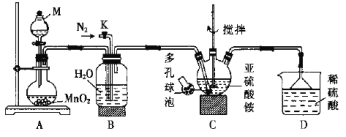
实验步骤如下:
①按图连接好装置,检查装置气密性;
②取200 mL 0.5000 mol•L-1(NH4)2SO3溶液(调节pH = 8)装入三颈烧瓶中,加入催化剂,控制气体流速为300 L•h-1,在温度为50℃下进行实验;
③反应2.5 h后,测定反应后溶液中SO32-的浓度。
回答下列问题:
(1)仪器M的名称为_____,仪器M中装有H2O2溶液,则装置A中发生反应的化学方程式为_______。
(2)实验中通如N2的目的是_____。
(3)装置B的作用是_____(任答一条)。
(4)装置C中采用多孔球泡的目的是_____,已知亚硫酸铵溶液的pH小于8,要调节装置C中溶液的pH=8,应向该溶液中加入一定量的_____(填标号
a NH3 • H2O b Ba(OH)2 c 澄清石灰水
(5)该实验缺少的装置是_____。
(6)取VmL反应后的溶液(反应前后体积不变)于碘量瓶中,滴入3滴淀粉溶液,用a mol•L-1的标准碘溶 液滴定至终点时,消耗碘水的体积为b mL,则(NH4 )2SO3的转化率为_____。