-
X、Y、Z、W为原子序数依次增大的短周期元素,它们位于两个主族。常温下,0.01mol∙L-1ZYX溶液的pH为12。下列相关说法正确的是( )
A.Z与W形成的化合物水溶液呈酸性
B.W的氧化物对应的水化物一定为强酸
C.由Y、Z、W三种元素形成的化合物不止两种
D.化合物X2Y、X2Y2中,Y不一定满足8电子结构
难度: 简单查看答案及解析
-
下列化学方程式中,不能正确解释该反应颜色变化的是
A.“以曾青涂铁,铁赤色如铜”(曾青的主要成分为CuSO4):Fe+CuSO4═FeSO4+Cu
B.铜片加入盛有稀硝酸的试管中,瓶口有红棕色气体:2NO+O2═2NO2
C.CuO投入稀硫酸中。黑色固体溶解。溶液呈蓝色:CuO+2H+═Cu2++H2O
D.向FeI2酸性溶液(浅绿色)中滴入少量H2O2稀溶液,溶液变黄:2Fe2++H2O2+2H+═2Fe3++2H2O
难度: 中等查看答案及解析
-
化学与生产、生活、环境和科技均密切相关。下列有关说法不正确的是( )
A.双曲线二号火箭是液氧甲烷动力运载火箭,该类火箭燃料燃烧产生的气体会形成酸雨
B.生活中用明矾净水和用氯化铵浓溶液除铁锈,都与盐类水解有关
C.煤的液化和以离子交换法淡化海水的过程都发生了化学变化
D.用木质纤维和人造蜘蛛丝制得的材料有望替代塑料,木质纤维属于高分子化合物
难度: 中等查看答案及解析
-
下列物质或离子在指定分散系中能大量共存的是( )
A.Ca(ClO)2溶液中:K+、Na+、NO3-、Cl-
B.Fe(OH)3胶体中:Na+、H+、Cl-、I-
C.空气中:H2、HCl、NO、NH3
D.无色透明溶液中:K+、Na+、MnO4-、SO42-
难度: 中等查看答案及解析
-
中国制造彰显中国力量,在电影《厉害了,我的国》中重点介绍了中国制造的重点工程,下列所涉及的材料不属于无机非金属材料的是( )

世界最大射电望远镜“中国天眼”

“嫦娥四号”月球探测器

中国大飞机C919

中国第一艘深海载人潜水器“蛟龙号”
A.光导纤维传输线
B.晶体硅芯片
C.新型铝锂合金机翼
D.氮化硅陶瓷发动机
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列物质的化学性质与实际应用对应关系正确的是( )
化学性质
实际应用
A
NH3具有碱性
用作制冷剂
B
SO2是酸性氧化物
用于纸张漂白
C
漂白粉具有氧化性
用于漂白织物
D
FeCl3能与碱溶液反应
用于蚀刻铜制线路板
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
设
为阿伏加德罗常数的数值,下列说法正确的是( )
A.100g 46%甘油水溶液中含—OH的数目为1.5NA
B.1.7g由NH3与13CH4组成的混合气体中含质子总数为NA
C.0.1mol∙L-1的Al2(SO4)3溶液中含Al3+的数目小于0.2 NA
D.反应CH4 + 2NO + O2 = CO2 + N2 + 2H2O,每消耗标准状况下22.4L NO,反应中转移的电子数目为2 NA
难度: 简单查看答案及解析
-
中国科技大学改进Pd/Al2O3催化H2还原CO2的生产工艺,其机理如图所示,下列说法不正确的是( )

A.金属钯是优良的贮氢材料
B.①→②为CO2发生加成反应
C.④中CO被氧化为CH3OH
D.总反应方程式是CO2+4H2
CH4+2H2O
难度: 中等查看答案及解析
-
环丙烯基甲酰氯(甲)是合成查尔酮抑制剂的中间体,可由甲在一定条件下制备乙,下列相关叙述不正确的是( )
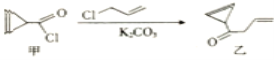
A.该反应属于取代反应
B.甲分子中的所有碳原子处于同一平面
C.丙是乙的同分异构体,丙可能属于芳香族化合物
D.甲和乙均能使溴水和酸性高锰酸钾溶液褪色
难度: 中等查看答案及解析
-
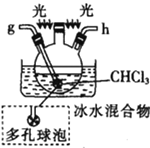
氯气氧化HBr提取溴的新工艺反应之一为:6H2SO4+5BaBr2+Ba(BrO3)2=6BaSO4↓+6Br2+6H2O,利用此反应和CCl4得到液溴的实验中不需要用到的实验装置是
A.
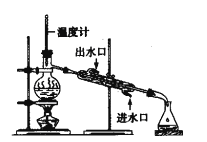
B.
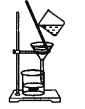
C.
D.
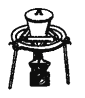
难度: 中等查看答案及解析
-
甲烷与氧气反应过程中的能量变化如图所示。下列有关说法中正确的是( )
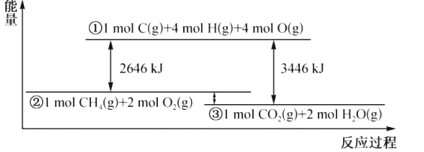
A.CH4(g)的能量大于CO2(g)和H2O(g)的能量总和
B.反应CH4(g)+2O2(g)=CO2(g)+2H2O(1) △H=-800kJ•mol-1
C.若破坏1molO2(g)中的化学键需吸收热量493kJ,则破坏1molC-H键需吸收热量415kJ
D.在反应CH4(g)+2O2(g)═CO2(g)+2H2O(g)中,放出热量400kJ,有1molO-H键生成
难度: 中等查看答案及解析
-
复旦大学王永刚的研究团队制得一种柔性水系锌电池,该可充电电池以锌盐溶液作为电解液,其原理如图所示。下列说法不正确的是
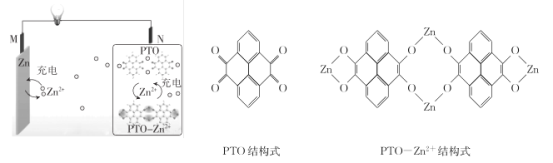
A.放电时,N极发生还原反应
B.充电时,Zn2+向M极移动
C.放电时,每生成1 mol PTO- Zn2+ ,M极溶解Zn的质量为260 g
D.充电时,N极的电极反应式为2PTO+8e- +4Zn2+=PTO- Zn2+
难度: 中等查看答案及解析
-
下列实验能达到相应目的的是( )
选项
实验
目的
A
先向Na2SO3固体中滴加过量稀硝酸,然后再滴加BaCl2溶液
验证Na2SO3已被氧化变质
B
将混合气体先通过足量的饱和NaHCO3溶液,再通过足量的浓硫酸
除去CO2中的SO2
C
以Mg、Al为两个电极,NaOH溶液为电解质溶液,用导线连接两个电极形成原电池装置
验证Mg的金属活动性比Al的强
D
向10mL0.01mol•L-1NaCl溶液中加入20mL0.01mol•L-1AgNO3溶液,然后再滴加5mL0.01mol•L-1Na2S溶液
比较Ksp(Ag2S)和Ksp(AgCl)的大小
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
从废钴酸锂电池正极片(LiCoO2、乙炔炭黑、Al箔)中回收钴和锂的流程如图:下列说法错误的是( )
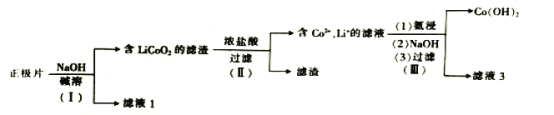
A.步骤(Ⅰ)中的滤液1中含有AlO2-
B.步骤(Ⅱ)中的浓盐酸可用浓硝酸代替
C.步骤(Ⅲ)中的滤液3可用于回收锂
D.合理处理废旧电池有利于保护环境和资源再利用
难度: 中等查看答案及解析
-
25℃时,往二元弱酸的钠盐Na2A溶液中通入HCl,溶液中-lg
和-lgc(A2-)的关系如图所示。下列说法正确的是( )
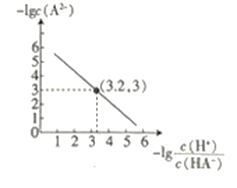
A.K(HA-)的数量级为10-7
B.通入HCl的过程中,水电离出的c(H+)不断增大
C.在Na2A溶液中:c(OH-)= c(H2A)+ c(HA-)+ c(H+)
D.当通入的HCl的物质的量与Na2A的物质的量相等时c(Na+)+ c(H+)= c(HA-)+2 c(A2-)+ c(OH-)
难度: 中等查看答案及解析


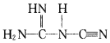 中含有σ键的物质的量为__。
中含有σ键的物质的量为__。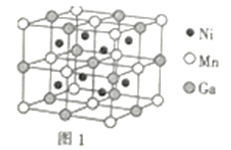

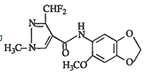 ,其合成路线如图所示:
,其合成路线如图所示: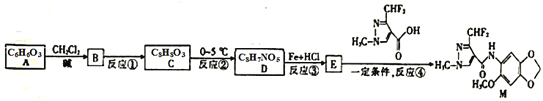
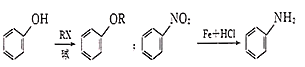
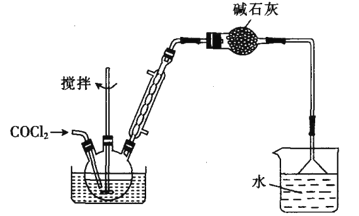
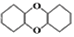 ,写出制备的合成路线流程图。(无机试剂任用)__。
,写出制备的合成路线流程图。(无机试剂任用)__。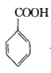 +COCl2
+COCl2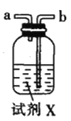 乙.
乙. 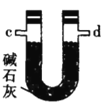 丙.
丙. 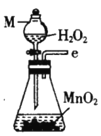 丁.
丁.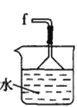 戊.
戊.