-
下列有关说法正确的是()
A.用福尔马林进行居室内环境消毒
B.聚酯纤维是制作运动衣的材料,是水溶性纤维
C.人体内无纤维素酶,故纤维素在人体内无法被分解利用
D.现代轨道交通中用到大量的合金钢,它的主要成分是碳
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数值。下列有关叙述正确的是()
A.标准状况下,1.12L酒精含有分子数为0.05NA
B.0.1molFe与足量的Cl2反应,转移电子数为0.2NA
C.10gKHCO3和CaCO3的混合固体中,氧原子数为0.3NA
D.常温常压下,2.24LN2所含原子数为0.2NA
难度: 简单查看答案及解析
-
咖啡是世界三大饮料之一,因其含有咖啡因(结构简式为
)使人神经兴奋,影响人的睡眠。最近科学家用超临界二氧化碳提取咖啡因,成功制得了无因咖啡。下列说法错误的是()
A.咖啡因的化学式为C8H10N4O2
B.咖啡因是可溶于水的高分子化合物
C.咖啡因在一定条件下可与氢气发生加成反应
D.超临界二氧化碳提取咖啡因的操作是萃取
难度: 中等查看答案及解析
-
下列实验中,对应实验现象及结论都正确的是()
选项
实验
现象
结论
A
向KMnO4溶液中通入SO2气体
KMnO4溶液褪色
SO2有漂白性
B
将蓝色石蕊试纸浸入氯水中
试纸先变红,后变白
氯水既有酸性又有漂白性
C
向硅酸中分别加入HF和NaOH溶液
白色的硅酸沉淀溶解
硅酸具有两性
D
将充满NO2的试管倒置在水槽中
试管充满水
NO2与水完全反应
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
瑞典科学家研制出了一种能作为电池的“纸”,由纳米纤维素制成,这种“纸”的纤维能做到只有20纳米厚(人的头发直径约为10万纳米,是该纤维厚度的5000倍。)在纳米纤维的外层,覆盖着一层溶解在NaOH水溶液里的带电聚苯乙烯塑料。这种柔性纸电池为未来柔性手机的开发成为可能。它用硅、惰性石墨烯为电极。下列说法正确的是()
A.正极反应中有大量的CO2生成
B.纸电池的负极是硅,发生还原反应
C.在石墨电极表面有O2生成
D.电池放电时,溶液的pH值变小
难度: 简单查看答案及解析
-
在25mL某浓度的氨水中逐滴加入0.01mol/L的盐酸溶液,曲线如图所示,有关粒子浓度关系正确的是()
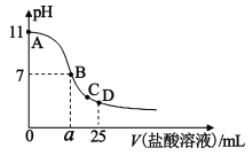
A.该氨水的浓度为0.001mol/L
B.在B点:a=12.5,且有c(NH4+)=c(Cl−)=c(OH−)=c(H+)
C.在C点:c(Cl−)>c(NH4+)>c(H+)>c(OH−)
D.在D点:c(NH4+)+c(NH3·H2O)=c(Cl−)
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W的原子序数依次增大。X的最外层电子数是内层电子数的3倍,W与X位于同一主族,Y、Z、W的最高价氧化物对应水化物两两之间可以反应。下列说法正确的是()
A.原子半径大小X<Y<Z<W
B.阴离子的还原性X>W
C.X分别与Y、W形成的化合物中化学键类型相同
D.四种元素中的某三种形成的盐可能呈酸性、中性或碱性
难度: 中等查看答案及解析
 =),随两气体平衡分压的变化关系如下图所示:
=),随两气体平衡分压的变化关系如下图所示: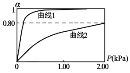
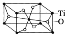
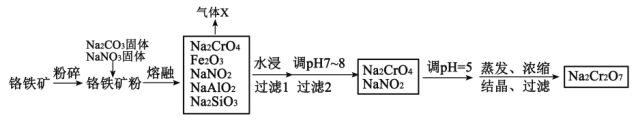

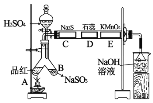
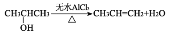 。
。