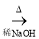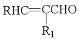-
反应A(g)+B(g) ⇋3X,在其他条件不变时,通过调节容器体积改变压强,达平衡时c(A)如下表:
平衡状态
①
②
③
容器体积/L
40
20
1
c(A)( mol/L)
0.022a
0.05a
0.75a
下列分析不正确的是( )
A.①→②的过程中平衡发生了逆向移动
B.①→③的过程中X的状态发生了变化
C.①→③的过程中A的转化率不断增大
D.与①②相比,③中X的物质的量最大
难度: 中等查看答案及解析
-
下列说法不正确的是
A.为了提高消杀效果可将任意两种消毒剂混合使用
B.大量使用含丙烷、二甲醚等辅助成分“的空气清新”会对环境造成新的污染
C.大部分药物都有毒副作用,应该在医生指导下使用
D.一次性医用外科口罩必须进行集中回收处理
难度: 中等查看答案及解析
-
下列表述正确的是
A.中子数为18的氯原子:
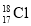
B.次氯酸的电子式:
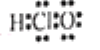
C.丁烷的球棍模型:
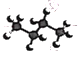
D.F的原子结构示意图:
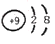
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是
A.1mol氨基(-NH2)含有电子数目为10NA
B.2gH218O中所含中子、电子数目均为NA
C.pH=1的H2SO4溶液10L,含H+的数目为2NA
D.电解精炼铜时,若阳极质量减少32g,则阳极失去的电子数为NA
难度: 中等查看答案及解析
-
不能正确表示下列变化的离子方程式是
A.二氧化硫与酸性高锰酸钾溶液反应:5SO2+2H2O+2MnO4-2Mn2++5SO
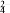 +4H+
+4H+B.酸性碘化钾溶液中滴加适量双氧水:2I−+2H++H2O2I2+2H2O
C.硅酸钠溶液和盐酸反应:SiO32-+2H+H2SiO3↓
D.硫酸铜溶液中加少量的铁粉:3Cu2++2Fe2Fe3++3Cu
难度: 困难查看答案及解析
-
下列说法正确的是
A.中和同体积同pH的盐酸和醋酸,消耗同浓度的烧碱溶液的体积相同
B.常温下,pH=5的盐酸与pH=5的硫酸铵溶液中c(H+)不同
C.相同物质的量浓度的醋酸和醋酸钠溶液中的c(CH3COO-)不同
D.常温下,同浓度的NaA、NaB溶液的pH前者大于后者,则Ka(HA)>Ka(HB)
难度: 中等查看答案及解析
-
运载火箭以液氢为燃烧剂,液氧为氧化剂。已知:
①H2(g)=H2(l)ΔH=-0.92kJ•mol-1
②O2(g)=O2(l)ΔH=-6.84kJ•mol-1
下列说法正确的是
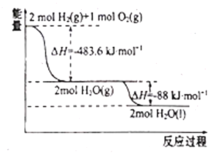
A.氢气的燃烧热为ΔH=-241..8kJ•mol-1
B.火箭中液氢燃烧的热化学方程式为2H2(l)+O2(l)=H2O(g)ΔH=-474.92kJ•mol-1
C.2molH2(g)与1molO2(g)所具有的总能量比2molH2O(g)所具有的总能量低
D.H2O(g)变成H2O(l)的过程中,断键吸收的能量小于成键放出的能量
难度: 简单查看答案及解析
-
某有机物X的结构简式如图所示,下列有关说法正确的是
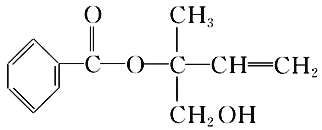
A.X在一定条件下能发生加成、加聚、取代、消去等反应;
B.在催化剂的作用下,lmolX最多能与5molH2加成
C.X的分子式为C12H16O3
D.可用酸性高锰酸钾溶液区分苯和X
难度: 中等查看答案及解析
-
下列有关物质性质的比较,结论正确的是
A.溶解度:Na2CO3<NaHCO3
B.热稳定性:HCl<PH3
C.沸点:C2H5SH<C2H5OH
D.碱性:LiOH<Be(OH)2
难度: 中等查看答案及解析
-
一下列根据实验操作和实验现象所得出的结论中,正确的是
选项
实验操作
现象
结论
A
25℃分别测定等浓度的K2SO3、KCl溶液的pH
pH:K2SO3>KCl
非金属性:Cl>S
B
溴乙烷与氢氧化钠乙醇溶液混合、加热,将产物通入盛有酸性高锰酸钾溶液的洗气瓶。
高锰酸钾溶液褪色
反应生成了乙烯
C
添加有KIO3的食盐中加入淀粉溶液、稀盐酸及KI
溶液变蓝色
氧化性:IO3->I2
D
向盛有2mL0.2mol/LAgNO3溶
液的试管滴中加5~6滴2mol/LNaCl后,再滴加几滴0.2mol/LNa2S
初始观察到白色沉淀,滴加Na2S后观察到黑色沉淀
Ksp(Ag2S)<Ksp(AgCl)
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
水浴加热滴加酚酞的NaHCO3溶液,颜色及pH随温度变化如下(忽略水的挥发):
时间
①
②
③
④
⑤
温度/℃
20
30
40
从40℃冷却到时20℃
沸水浴后冷却到20℃
颜色变化
红色略加深
红色接近①
红色比③加深较多
pH
8.31
8.29
8.26
8.31
9.20
下列说法不正确的是
A.①→③的过程中,pH略微下降说明升温过程中c(OH-)减小
B.NaHCO3溶液显碱性的原因:
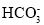 +H2O
+H2O H2CO3+OH-
H2CO3+OH-C.⑤比①pH增大,推测是由于NaHCO3分解生成的Na2CO3的缘故
D.①→③的过程中,颜色加深的原因可能是
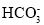 水解程度增大
水解程度增大难度: 困难查看答案及解析
-
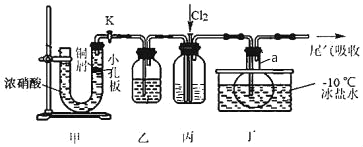
科研人员借肋太阳能;将H2S转化为可以再利用的S和H2工作原理如图所示,下列叙述正确的是
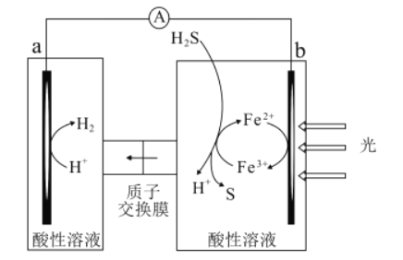
A.该电池能实现化学能转化为光能
B.a电极的电极反应:2H++2e-=H2↑
C.光照后,b电极的电极反应:H2S-2e-=2H++S
D.a电极区溶液的pH增大
难度: 中等查看答案及解析
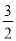 O2(g)=CO2(g)+2H2O(1) ΔH1
O2(g)=CO2(g)+2H2O(1) ΔH1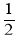 O2(g)=CO2(g) ΔH2
O2(g)=CO2(g) ΔH2 CH3OH(g)反应,下列示意图能说明该反应在进行到t1时刻为平衡状态的是__________(填选项字母)。
CH3OH(g)反应,下列示意图能说明该反应在进行到t1时刻为平衡状态的是__________(填选项字母)。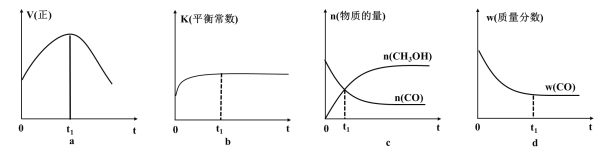
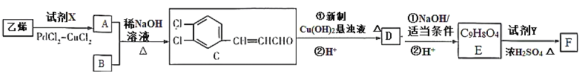
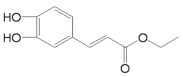 ),在自身免疫性疾病的治疗中有着重要的应用.工业上以乙烯和芳香族化合物B为基本原料制备F的路线图如下:
),在自身免疫性疾病的治疗中有着重要的应用.工业上以乙烯和芳香族化合物B为基本原料制备F的路线图如下: