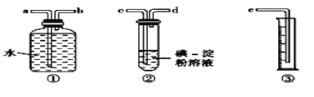
-
NaNO2像食盐一样有咸味,有很强的毒性,误食亚硝酸钠(NaNO2)会使人中毒。已知亚硝酸钠能发生如下反应:2NaNO2+4HI═2NO↑+I2+2NaI+2H2O。下列说法正确的是( )
A.该反应的氧化剂为HI
B.反应产物中能使淀粉变蓝的物质有I2、NaI
C.该反应中氧化剂与还原剂物质的量之比为1:1
D.人误食亚硝酸钠中毒时,可以服用HI溶液解毒
难度: 中等查看答案及解析
-
下列物质性质或反应在生活中的应用错误的是
A.合金具有优良性能,可用于制造新型金属材料
B.氧化铁俗称铁红,可用作红色油漆和外墙涂料
C.二氧化硫具有漂白性,常用来漂白食品
D.HF与SiO2的反应可用作在玻璃器皿上刻蚀标记
难度: 简单查看答案及解析
-
下列说法正确的是
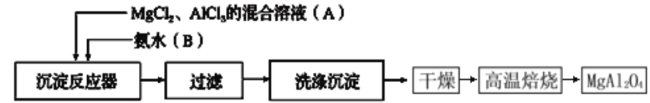
A.用氨水可以鉴别MgCl2溶液和AlCl3溶液
B.金属钠与CuSO4溶液反应能析出单质Cu
C.保存FeCl3溶液时,通常在溶液中加少量的单质铁
D.向混有少量泥沙的浑浊水中加少量硫酸铁,一会儿水可变得清澈透明
难度: 简单查看答案及解析
-
下列表格中有关物质的分类对应正确的一组是( )
碱
盐
电解质
混合物
A
纯碱
小苏打
BaSO4
盐酸
B
烧碱
食盐
NH3•H2O
CuSO4•5H2O
C
KOH
CaCO3
醋酸
水玻璃
D
NH3
Na2S
明矾
磁性氧化铁
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列叙述不正确的是
A.氢氧化铝可以用于治疗胃酸过多
B.利用澄清石灰水可鉴别Na2CO3溶液与NaHCO3溶液
C.Na2O和Na2O2所含的阴阳离子个数比相同
D.为使面包松软可口可用碳酸氢钠做发泡剂
难度: 简单查看答案及解析
-
下列对实验过程的评价正确的是
A.某无色溶液中滴入酚酞试液显红色,说明该溶液一定是碱溶液
B.某固体中加入稀盐酸,产生了无色无味气体,证明该固体一定是CaCO3
C.验证烧碱溶液中是否含有Cl-,先加稀盐酸除去OH-,再加硝酸银溶液,有白色沉淀出现,证明含Cl-
D.向碘水中滴CCl4,振荡静置后,CCl4层呈紫色,说明可用CCl4萃取碘水中碘
难度: 中等查看答案及解析
-
下列有关胶体的说法中,不正确的是( )
A.胶体、溶液、浊液的分类依据是分散质微粒直径大小
B.“卤水点豆腐”、“不同牌子的墨水不能混用”都与胶体的聚沉有关
C.从颜色上无法区别氯化铁溶液和氢氧化铁胶体
D.可以用丁达尔现象区别硫酸铜溶液和氢氧化铁胶体
难度: 简单查看答案及解析
-
下列实验过程中出现的异常情况,其可能原因分析错误的是( )
选项
异常情况
可能原因分析
A
蒸发结晶:蒸发皿破裂
将溶液蒸干或酒精灯灯芯碰到热的蒸发皿底部
B
分液:分液漏斗中的液体难以滴下
没有打开分液漏斗活塞,或玻璃塞上凹槽与漏斗口侧面的小孔没有对齐
C
萃取时,震荡溶液,液体静置不分层
加入萃取剂的量较多
D
蒸馏:冷凝管破裂
冷凝管没有通水或先加热后通水
【选项A】A 【选项B】B 【选项C】C 【选项D】D
难度: 简单查看答案及解析
-
下列叙述错误的是( )
①摩尔是国际单位制中七个基本物理量之一; ②1 mol任何物质都含有约6.02×1023个原子;③6.02×1023就是阿伏加德罗常数;④氢原子的摩尔质量是1 g;⑤HCl的摩尔质量等于1 mol HCl分子的质量;⑥1 mol CO2中含有1 mol碳和2 mol氧。
A.①②③ B.②③④ C.②③④⑥ D.全部
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法中正确的是
A.1mol/LFeCl3溶液中含有Cl-数为3NA
B.0.1molCl2与足量NaOH溶液反应转移的电子数为0.2NA
C.用KMnO4、H2O2分别制取0.1molO2转移电子数均为0.4NA
D.标准状况下,18gH2O的体积小于22.4L
难度: 简单查看答案及解析
-
下列除去杂质的方法中,正确的是
选项
物质(括号内为杂质)
去除杂质的方法
A
NaCl(Na2CO3)
加入适量的Ca(OH)2溶液、过滤
B
CaO(CaCO3)
加水、过滤
C
Fe(Al)
加过量NaOH溶液、过滤
D
FeCl2(FeCl3)
向FeCl2溶液中通入过量氯气
A.A B.B C.C D.D
难度: 简单查看答案及解析
-
下列有关叙述正确的是
A.相同条件下,质量相等的CO和CO2它们所含的氧原子数目之比为11:7
B.1L 0.45 mol/L NaCl溶液中Cl-物质的量浓度比0.1L 0.15mol/L AlCl3溶液大
C.60g SiO2中含有NA个SiO2分子
D.同体积、同密度的C2H4和CO,两种气体的分子数一定相等
难度: 简单查看答案及解析
-
下列溶液中,Cl-浓度最大的是
A.60mL0.3mol/L的NaCl溶液
B.20mL0.2mol/L的AlCl3溶液
C.40mL0.2mol/L的MgCl2溶液
D.30mL0.4mol/L的KCl溶液
难度: 简单查看答案及解析
-
高温下硫酸亚铁发生如下反应:2FeSO4
 Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是
Fe2O3+SO2↑+SO3↑,若将生成的气体通入氯化钡溶液中,得到的沉淀物是A.BaSO3和BaSO4 B.BaSO4 C.BaSO3 D.BaS
难度: 简单查看答案及解析
-
在FeCl3、CuCl2混合溶液中,加入一定量的铁屑,反应完全后将固体滤出,下列说法中正确的是
A.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+
B.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe2+,可能含Cu2+和Fe3+
C.若滤出的固体中只有铜,则溶液中一定含有的阳离子是Fe3+和Fe2+,一定不含Cu2+
D.若滤出的固体中含有铁和铜,则溶液中一定含有的阳离子是Fe2+,一定不含Cu2+和Fe3+
难度: 中等查看答案及解析
-
氯水中存在多种分子和离子,它们在不同的反应中表现各自的性质。下列实验现象和结论一致且正确的是( )
A. 加入有色布条,一会儿有色布条退色,说明有Cl2存在
B. 溶液呈黄绿色,且有刺激性气味,说明有HClO分子存在
C. 先加入硝酸酸化,再加入AgNO3溶液产生白色沉淀,说明有Cl-存在
D. 加入NaOH溶液,氯水黄绿色消失,说明有HClO分子存在
难度: 简单查看答案及解析
-
在下列各溶液中,离子一定能大量共存的是
A.加入金属铝产生H2的溶液中:
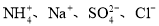
B.室温下,能使紫色石蕊溶液变红的溶液中:
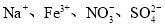
C.含有0.1mol/L Ca2+的溶液中:
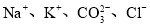
D.含Fe3+的溶液中:
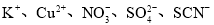
难度: 简单查看答案及解析
-
下列离子方程式书写正确的是
A.向Na2SiO3溶液中滴加稀盐酸:
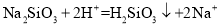
B.碳酸氢钠溶液与硫酸氢钠溶液反应:
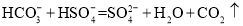
C.AlCl3溶液中加入过量的氨水:
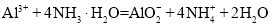
D.用澄清石灰水检验二氧化碳:
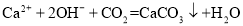
难度: 简单查看答案及解析
-
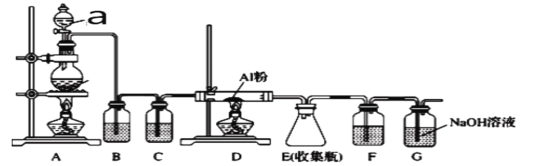
某化学小组在实验室中从海带灰浸取液获得纯碘实验方案如图所示,
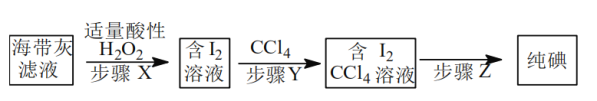
下列说法不正确的是
A.步骤X发生:
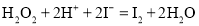
B.步骤Y中不能用酒精代替CCl4
C.步骤Y中要使用分液漏斗
D.步骤Z是过滤
难度: 简单查看答案及解析
-
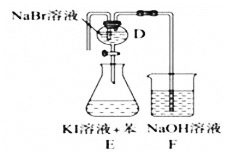
向200mLFeBr2溶液中通入标况下氯气3.36L,氯气全部被还原,已知还原性:
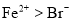 ,测得溶液
,测得溶液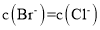 ,原溶液中FeBr2溶液的物质的量浓度是( )mol/L
,原溶液中FeBr2溶液的物质的量浓度是( )mol/LA.1 B.1.5 C.2 D.2.5
难度: 中等查看答案及解析
-
某无色、澄清溶液中可能含有①Na+、②SO42-、③Cl-、④HCO3-、⑤CO32-、⑥H+、⑦Cu2+中的若干种,依次进行下列实验,且每步所加试剂均过量,观察到的现象如下:
步骤
操作
现象
(1)
用紫色石蕊试液检验
溶液变红
(2)
向溶液中滴加BaCl2和稀HCl
有白色沉淀生成
(3)
将(2)中所得混合物过滤,向滤液中加入AgNO3溶液
和稀HNO3
有白色沉淀生成
下列结论正确的是
A.肯定含有的离子是②③⑥
B.该实验无法确定是否含有③
C.可能含有的离子是①③⑦
D.肯定没有的离子是④⑤,可能含有的离子是②
难度: 中等查看答案及解析
-
从某含有FeCl2、FeCl3、CuCl2的工业废液中回收铜并制备氯化铁晶体的流程如图:
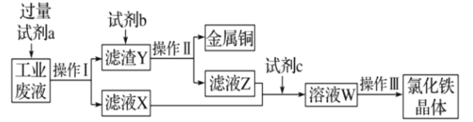
则下列说法正确的是
A.试剂a是铁、试剂b是稀硫酸
B.用酸性KMnO4溶液可检验溶液W中是否还有Fe2+
C.操作Ⅰ、操作Ⅱ、操作Ⅲ所用仪器相同
D.试剂c是氯气,相应的反应为
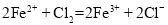
难度: 中等查看答案及解析
-
A是一种常见的单质,B、C为中学常见的化合物,A、B、C均含有元素 X。它们有如图所示的转化关系(部分产物及反应条件已略去),下列判断正确的是( )
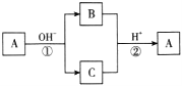
A.X元素不一定为非金属元素 B.单质A可能是Cl2,不能是S
C.反应①和②一定为氧化还原反应 D.反应①和②都为复分解反应
难度: 中等查看答案及解析
-
将15.6 g Na2O2和5.4 g Al同时放入一定量的水中,充分反应后得到200 mL溶液,再缓慢通入HCl气体6.72 L(标准状况),若反应过程中溶液的体积保持不变,则
A.反应过程中得到6.72 L的气体(标准状况)
B.最终得到的溶液中溶质为NaCl和NaOH
C.最终得到15.6 g沉淀
D.最终得到的溶液中NaCl的物质的量浓度为1.5 mol·L-1
难度: 困难查看答案及解析
-
下图是一检验气体性质的实验装置。向装置中缓慢通入气体X,若关闭活塞K,则品红溶液无变化,而澄清石灰水变浑浊;若打开活塞K,则品红溶液褪色。据此判断气体X和洗气瓶内液体Y(足量)可能是( )
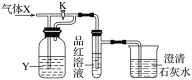
选项
A
B
C
D
X
CO
SO2
CO2
Cl2
Y
浓H2SO4
NaHCO3饱和溶液
Na2SO3溶液
NaHSO3饱和溶液
A.A B.B C.C D.D
难度: 中等查看答案及解析
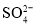 浓度为0.9mol/L,则
浓度为0.9mol/L,则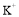 的物质的量浓度为________________。
的物质的量浓度为________________。