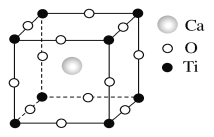
-
能够用键能的大小作为主要依据来解释的是( )
A.常温常压下氯气呈气态而溴单质呈液态
B.硝酸是挥发性酸,而硫酸、磷酸是不挥发性酸
C.稀有气体一般难于发生化学反应
D.空气中氮气的化学性质比氧气稳定
难度: 简单查看答案及解析
-
在解释下列物质的变化规律与物质结构间的因果关系时,与化学键的强弱无关的是( )
A.钠、镁、铝的熔点和沸点逐渐升高,硬度逐渐增大
B.金刚石的硬度大于晶体硅的硬度,其熔点也高于晶体硅的熔点
C.KF、KCl、KBr、KI的熔点依次降低
D.CF4、SiF4、GeF4、SnF4的熔点和沸点逐渐升高
难度: 中等查看答案及解析
-
下列各组物质中,所有化学键都是共价键的是( )
A.H2S和Na2O2 B.H2O2和CaF2 C.NH3和N2 D.HNO3和NaCl
难度: 简单查看答案及解析
-
晶体与非晶体的本质区别是( )
A.晶体有规则的几何外形,而非晶体没有规则的几何外形
B.晶体内部粒子有序排列,而非晶体内部粒子无序排列
C.晶体有固定的熔点,而非晶体没有固定的熔点
D.晶体的硬度大,而非晶体的硬度小
难度: 简单查看答案及解析
-
下列有关微粒性质的排列顺序正确的是
A.离子半径:O2->Na+>S2-
B.第一电离能:O>N>C
C.电负性:F>P>O
D.基态原子中未成对电子数:Mn>Si>Cl
难度: 中等查看答案及解析
-
下列各原子或离子的电子排布式正确的是( )
A.Mg2+ 1s22s22p6
B.Br [Ar]4s24p5
C.Fe3+ 1s22s22p63s23p63d34s2
D.Cr 1s22s22p63s23p63d44s2
难度: 简单查看答案及解析
-
下列原子的价电子排布图正确的是( )
A.N
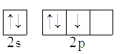
B.O
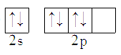
C.C
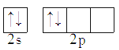
D.F
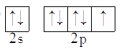
难度: 简单查看答案及解析
-
基态原子的核外电子在原子轨道上的能量大小关系不正确的是
A.3s>2s B.3p>3s
C.4s>3d D.3d>3s
难度: 简单查看答案及解析
-
短周期元素X、Y在周期表中的相对位置如图所示,且已知X基态原子的价电子排布为nsnnpn+1,下列说法不正确的是( )
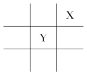
A.X元素的电负性大于Y B.X元素的第一电离能大于Y
C.X在周期表中位于第二周期第ⅢA族 D.原子半径Mg>Y
难度: 中等查看答案及解析
-
x、y为两种元素的原子,x的阴离子与y的阳离子具有相同的电子层结构,由此可知( )
A.x的原子半径大于y的原子半径 B.x的电负性小于y的电负性
C.x 的氧化性大于y的氧化性 D.x的第一电离能小于y 的第一电离能
难度: 简单查看答案及解析
-
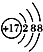
下列化学用语的表达正确的是
A.原子核内有10个中子的氧原子:
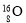
B.氯原子的结构示意图:
C.Fe3+的最外层电子排布式:3s23p63d5
D.基态铜原子的价层电子排布图:
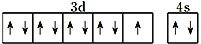
难度: 简单查看答案及解析
-
下列四种元素中,其单质氧化性最强的是
A.原子含有未成对电子最多的第2周期元素
B.位于周期表第3周期ⅢA族的元素
C.原子最外电子层排布式为3s23p5的元素
D.原子最外电子层排布式为2s22p6的元素
难度: 中等查看答案及解析
-
化合物中,稀土元素最常见的化合价是+3 ,但也有少数的稀土元素可以显示+4价,观察下面四种稀土元素的电离能数据,判断最有可能显示+4价的稀土元素是
(几种稀土元素的电离能(单位:KJ/mol))
元素
I1
I2
I3
I4
A.Se(钪)
633
1235
2389
7019
B.Y(铱)
616
1181
1980
5963
C.La(镧)
538
1067
1850
4819
D.Ce(铈)
527
1047
1949
3547
A. A B. B C. C D. D
难度: 困难查看答案及解析
-
用VSEPR模型预测下列分子或离子的立体结构,其中正确的是( )
A.H2O与BeCl2为角形(V形) B.CS2与SO2为直线形
C.BF3与PCl3为三角锥形 D.SO3与CO
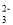 为平面三角形
为平面三角形难度: 中等查看答案及解析
-
下列分子和离子中,中心原子价层电子对的几何构型为四面体且分子或离子的空间构型为V形的是( )
A.OF2 B.SO2 C.H3O+ D.NH4+
难度: 中等查看答案及解析
-
下列分子或离子的中心原子,带有一对孤对电子的是( )
A.XeO4 B.BeCl2 C.CH4 D.PCl3
难度: 简单查看答案及解析
-
下列分子中心原子是sp2杂化的是( )
A.PBr3 B.CH4 C.BF3 D.H2O
难度: 简单查看答案及解析
-
若不断地升高温度或在一定条件下,实现“雪花
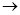 水
水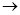 水蒸气
水蒸气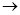 氧气和氢气”的变化。在变化的各阶段被破坏的粒子间的主要相互作用依次是
氧气和氢气”的变化。在变化的各阶段被破坏的粒子间的主要相互作用依次是A.氢键;氢键;极性键 B.氢键;范德华力;非极性键
C.氢键;极性键;范德华力 D.范德华力;氢键;非极性键
难度: 简单查看答案及解析
-
下列关于丙烯(CH3—CH=CH2)的说法错误的是( )
A.丙烯分子有8个σ键,1个π键
B.丙烯分子中3个碳原子都是sp3杂化
C.丙烯分子存在非极性键
D.丙烯分子中最多有7个原子在同一平面上
难度: 简单查看答案及解析
-
已知通常分子中所含的键能越大,分子越稳定。参考下表中化学键的键能数据,判断下列分子中,受热时最不稳定的是( )
化学键
H—H
H—Cl
H—Br
H—I
键能kJ·mol-1
436.0
431.8
366
298.7
A.氢气 B.氯化氢
C.溴化氢 D.碘化氢
难度: 中等查看答案及解析
-
根据等电子原理,下列各对粒子中,空间结构相似的是( )
A.SO2与O3 B.CO2与NO2
C.CS2与NO2 D.PCl3与BF3
难度: 中等查看答案及解析
-
已知氯化铝易溶于苯和乙醚,其熔点为190℃,则下列结论不正确的是( )
A.氯化铝是电解质
B.固态氯化铝是分子晶体
C.固态氯化铝是离子晶体
D.氯化铝为非极性分子
难度: 中等查看答案及解析
-
下列有关离子晶体的数据大小比较不正确的是( )
A. 熔点:NaF>MgF2>AlF3 B. 晶格能:NaF>NaCl>NaBr
C. 阴离子的配位数:CsCl>NaCl>CaF2 D. 硬度:MgO>CaO>BaO
难度: 中等查看答案及解析
-
下列现象与氢键有关的是( )
①NH3的熔、沸点比第ⅤA族其他元素氢化物的熔、沸点高
②碳原子数较少的醇、羧酸可以和水以任意比互溶
③常温下H2O为液态,而H2S为气态
④水分子高温下也很稳定
A. ①②③④ B. ①②③ C. ②③④ D. ①
难度: 中等查看答案及解析
-
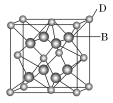
如图是氯化铯晶体的晶胞示意图(晶体中最小的重复结构单元),已知晶体中2个最近的Cs+核间距为a cm,氯化铯(CsCl)的相对分子质量M,NA为阿伏加德罗常数,则氯化铯晶体的密度为
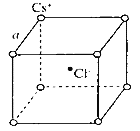
A.
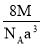 g· cm-3 B.
g· cm-3 B.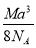 g· cm-3
g· cm-3C.
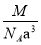 g· cm-3 D.
g· cm-3 D.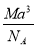 g· cm-3
g· cm-3难度: 中等查看答案及解析