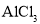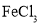-
下列化合物中同分异构体数目最少的是( )
A.戊烷 B.戊醇 C.戊烯 D.乙酸乙酯
难度: 中等查看答案及解析
-
反应X(g)+Y(g)⇌ 2Z(g)+Q (Q>0),达到平衡时,下列说法正确的是
A.减小容器体积,平衡向右移动 B.加入催化剂,Z的产率增大
C.增大c(X),X的转化率增大 D.降低温度,Y的转化率增大
难度: 中等查看答案及解析
-
X+的核外电子数分别为2、8、8,则X元素在周期表中的位置是( )
A.第三周期第0族 B.第四周期第ⅠA族
C.第三周期第ⅠA族 D.第三周期第ⅦA族
难度: 简单查看答案及解析
-
化学与人类生活、生产和社会可持续发展密切相关,下列说法错误的是( )
A.通过人工合成各种酯用作饮料、糖果、香水、化妆品中的香料;也可以用作指甲油、胶水的溶剂
B.加强生活垃圾分类与再生资源回收有利于践行“绿水青山就是金山银山”的理念
C.太阳能光催化环境技术可以将二氧化碳转化为燃料,该燃料属于一次能源
D.乙烯可作水果的催熟剂、料酒可以除去食物中的腥味
难度: 简单查看答案及解析
-
下列说法不正确的是()
A.pH<5.6降水通常称为酸雨;CO2的大量排放能破坏臭氧层,形成“臭氧空洞”
B.总质量一定时,乙酸和葡萄糖无论以何种比例混合,完全燃烧消耗氧气的量相等
C.燃煤时加入适量石灰石,可减少废气中SO2的量
D.有机高分子化合物称为聚合物或高聚物,是因为他们大部分是由小分子通过聚合反应制得的
难度: 简单查看答案及解析
-
下列化学用语正确的是( )
A. 羟基的电子式:
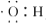 B. 丙烷分子的比例模型:
B. 丙烷分子的比例模型: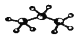
C. 1,3—丁二烯的分子式:C4H8 D. 甲酸甲酯的结构简式:C2H4O2
难度: 中等查看答案及解析
-
下列物质熔化时,没有破坏化学键的是( )
A.金刚石 B.干冰 C.氯化钠 D.晶体二氧化硅
难度: 中等查看答案及解析
-
下列有关物质性质的说法错误的是
A. 热稳定性:HCl> HI B. 原子半径:Na> Mg
C. 酸性:H2SO3>H2SO4。 D. 结合质子能力:S2-> Cl-
难度: 简单查看答案及解析
-
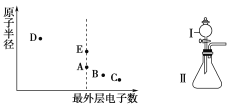
如图为元素周期表的一部分,其中A、B、C、D、E代表元素。下列说法错误的是( )

A.元素B、D对应族①处的标识为ⅥA
B.E的含氧酸酸性强于D的含氧酸
C.熔点:D的氧化物<C的氧化物
D.AE3分子中所有原子都满足8电子稳定结构
难度: 中等查看答案及解析
-
下列金属冶炼的反应原理及方程式书写,正确的是( )
A.2AlCl3(熔融)
 2Al+3Cl2↑ B.Fe2O3+2Al
2Al+3Cl2↑ B.Fe2O3+2Al Fe+Al2O3
Fe+Al2O3C.Cu2S+O2
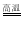 2Cu+SO2 D.Ag2O
2Cu+SO2 D.Ag2O 2Ag+O2↑
2Ag+O2↑难度: 简单查看答案及解析
-
下列叙述不正确的是( )
A.煤的综合利用的主要途径有:煤的干馏、煤的气化和煤的液化
B.实验室制取H2时,常用粗锌代替纯锌以加快反应的速率
C.将石油进行催化裂化,可以得到苯或甲苯等
D.四种基本反应类型中,只有化合反应的原子利用率为100%
难度: 简单查看答案及解析
-
下列装置或操作能达到实验目的的是
A.蒸馏石油
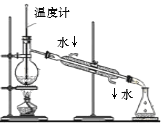 B.除去甲烷中少量乙烯
B.除去甲烷中少量乙烯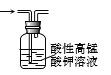 C.验证化学能转变电能
C.验证化学能转变电能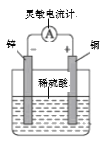 D.制取乙酸乙酯
D.制取乙酸乙酯
难度: 中等查看答案及解析
-
旧键断裂重组新键是有机反应的特点。如图是乙醇的结构式,乙醇在下列反应中化学键的断裂方式不正确的是( )
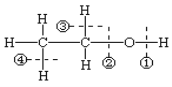
A.与金属钠反应:① B.与乙酸进行酯化:②
C.催化氧化:①③ D.实验室制取乙烯:②④
难度: 简单查看答案及解析
-
某有机物的结构简式如图所示,有关该有机物的叙述不正确的是( )
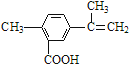
A.在一定条件下,能发生取代、氧化、酯化和加聚反应
B.该物质分子中最多可以有11个碳原子在同一平面上
C.1 mol该物质完全氧化最多可消耗14mol氧气
D.1 mol该物质最多可与4 mol H2发生加成反应
难度: 中等查看答案及解析
-
CO2的的资源化利用是解决温室效应的重要途径。以下是在一定条件下用NH3捕获CO2生成重要化工产品三聚氰胺的反应:NH3+CO2→
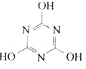 +H2O
+H2O下列有关三聚氰胺的说法正确的是
A.分子式为C3H6N3O3 B.分子中既含极性键,又含非极性键
C.属于共价化合物 D.生成该物质的上述反应为中和反应
难度: 简单查看答案及解析
-
下列实验操作和现象与结论的关系相符的是
操作和现象
结论
A
将一小块钠分别投入盛有水和乙醇的小烧杯中,钠与乙醇反应要平缓得多
乙醇分子中的氢与水分子中的氢具有相同的活性
B
在催化剂存在的条件下,石蜡油加强热生成的气体通入溴的四氯化碳溶液中,溶液褪色
石蜡油的分解产物中含有烯烃
C
甲烷与氯气在光照下反应后的混合气体能使湿润的石蕊试纸变红
生成的氯甲烷具有酸性
D
向蔗糖溶液中加入稀硫酸,水浴加热一段时间后,再加入新制Cu(OH)2悬浊液,用酒精灯加热,未见砖红色沉淀
蔗糖未水解
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
设NA为阿伏加德罗常数的值,下列说法正确的是( )
A.28g聚乙烯中含有NA个碳碳双键
B.1 mol乙烯与Cl2完全加成,然后与Cl2发生取代反应,共消耗Cl2分子数最多为6 NA
C.标准状况下,2.24L CCl4中的原子总数大于0.5 NA
D.17g羟基中含有的电子数为10 NA
难度: 简单查看答案及解析
-
研究表明金属铁能与N2O、CO反应,其反应的能量变化与反应进程如图所示,下列说法不正确的是( )

A.总反应为放热反应
B.加入铁,可使反应的焓变减小
C.Fe是该反应的催化剂
D.Fe+N2O→FeO+N2,FeO+CO→Fe+CO2两步反应均为放热反应
难度: 简单查看答案及解析
-
100g碳燃烧所得气体中,CO占
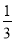 体积、CO2占
体积、CO2占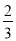 体积,且C(s)+
体积,且C(s)+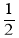 O2(g)=CO(g) ΔH(298K)=-110.35kJ·mol-1,CO(g)+
O2(g)=CO(g) ΔH(298K)=-110.35kJ·mol-1,CO(g)+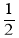 O2(g)=CO2(g) ΔH(298K)=-282.57kJ·mol-1。与这些碳完全燃烧相比较,损失的热量是( )
O2(g)=CO2(g) ΔH(298K)=-282.57kJ·mol-1。与这些碳完全燃烧相比较,损失的热量是( )A.392.92kJ B.2489.44kJ
C.784.92kJ D.3274.3kJ
难度: 中等查看答案及解析
-
已知:2CO(g)+O2(g)=2CO2(g) ΔH=-566 kJ/mol;Na2O2(s)+CO2(g)=Na2CO3(s)+
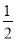 O2(g) ΔH=-226 kJ/mol,根据以上热化学方程式判断下列说法正确的是( )
O2(g) ΔH=-226 kJ/mol,根据以上热化学方程式判断下列说法正确的是( )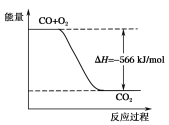
A.CO的燃烧热为283 kJ
B.如图所示为CO生成CO2的反应过程和能量的关系
C.2Na2O2(s)+2CO2(s) =2Na2CO3(s)+O2(g)ΔH>-452 kJ/mol
D.CO(g)与Na2O2(s)反应放出509 kJ热量时,转移电子数为6.02×1023
难度: 中等查看答案及解析
-
氢氧燃料电池可以使用在航天飞机上,其反应原理示意图如下图。下列有关氢氧燃料电池的说法正确的是( )
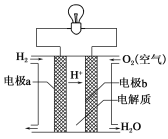
A.该电池工作时电能转化为化学能
B.该电池中电极a是正极
C.外电路中电子由电极b通过导线流向电极a
D.该电池的总反应:2H2+O2=2H2O
难度: 简单查看答案及解析
-
下列实验能达到实验目的的是( )
序号
实验内容
实验目的
A
盛有
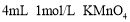 酸性溶液的两只试管,一只加入
酸性溶液的两只试管,一只加入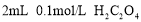 溶液,另一只加入
溶液,另一只加入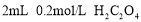 溶液
溶液探究浓度对反应速率的影响
B
向3 mL KI溶液中滴加几滴溴水,振荡,再滴加1mL淀粉溶液,溶液显蓝色
比较Br2 和I2的氧化性强弱
C
在容积可变的密闭容器中发生反应:2NO2(g)
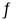 N2O4(g),把容器的体积缩小一半
N2O4(g),把容器的体积缩小一半正反应速率加快,逆反应速率减慢
D
向2支试管中各加入相同体积、相同浓度的
 溶液,再分别加入不同体积相同浓度的稀硫酸,分别放入冷水和热水中
溶液,再分别加入不同体积相同浓度的稀硫酸,分别放入冷水和热水中探究温度对反应速率的影响
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
反应A(s)+3B(g)
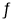 2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )
2C(g)+2D(g),在四种不同情况下用不同物质表示的反应速率分别如下,其中反应速率最大的是( )A.v(C)=0.02mol·(L·s)-1 B.v(B)=0.06mol·(L·min)-1
C.v(A)=1.5mol·(L·min)-1 D.v(D)=0.01mol·(L·s)-1
难度: 简单查看答案及解析
-
在容积固定的4L密闭容器里,进行可逆反应:X(g)+2Y(g)
 2Z(g), 并达到平衡,在此过程中,以Y的浓度改变 表示的反应速率v(正)、v(逆)与时间t的关系如图。则图中阴影部分面积表示( )
2Z(g), 并达到平衡,在此过程中,以Y的浓度改变 表示的反应速率v(正)、v(逆)与时间t的关系如图。则图中阴影部分面积表示( )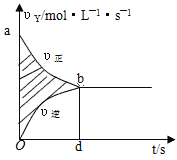
A.X的浓度减少
B.Y的物质的量减少
C.Z的浓度增加
D.X的物质的量减少
难度: 中等查看答案及解析
-
向绝热恒容密闭容器中通入SO2和NO2,一定条件下使反应
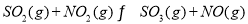 达到平衡,正反应速率随时间变化的示意图如下所示。下列叙述正确的是( )
达到平衡,正反应速率随时间变化的示意图如下所示。下列叙述正确的是( )
A.反应在c 点达到平衡状态
B.反应物浓度:
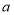 点小于
点小于 点
点C.反应物的总能量低于生成物的总能量
D.
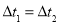 时,SO2的转化率:
时,SO2的转化率: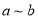 段小于
段小于 段
段难度: 中等查看答案及解析
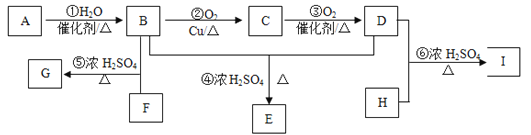
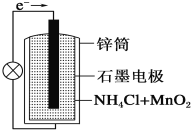
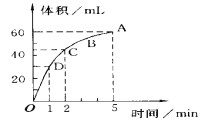
 向________(填“正极”或“负极”)移动。
向________(填“正极”或“负极”)移动。 2H2O+O2↑,反应过程中,测得不同时间H2O2的物质的量浓度如下表:
2H2O+O2↑,反应过程中,测得不同时间H2O2的物质的量浓度如下表: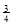 气体所需要的时间为________;A、B、C、D四点化学反应速率快慢的顺序为________。
气体所需要的时间为________;A、B、C、D四点化学反应速率快慢的顺序为________。