-
由下列实验及现象,推出的相应结论正确的是( )
实验
现象
结论
A.用铂丝蘸取某金属的盐溶液, 在酒精灯火焰上灼烧
火焰呈黄色
此盐溶液中含有 Na+,不含 K+
B.①取少量绿矾样品,加水溶解, 滴加 KSCN 溶液
②向溶液中通入空气
①溶液颜色无变化
②溶液逐渐变红
①绿矾样品未变质
②Fe2+易被空气氧化为 Fe3+
C.①某溶液中加入 Ba(NO3)2 溶 液
②再加入足量盐酸
①产生白色沉淀
②仍有白色沉淀
原溶液中有 SO42﹣
D.向碘水中加入等体积 CCl4, 振荡后静置
上层接近无色,下层显紫红色
I2 在 CCl4 中的溶解度小于在水中 的溶解度
A. A B. B C. C D. D
难度: 中等查看答案及解析
-
合金在生活材料中扮演着重要的角色,下列材料不属于合金的是( )
A. 黄铜 B. 储氢合金 C. 白金 D. 锰钢
难度: 中等查看答案及解析
-
化学与生活密切相关,下列说法错误的是( )
A. Na2CO3 属于盐类,但其溶液显碱性,故可用作食用碱
B. Al2O3 可用作耐高温材料,Al(OH)3 可用于中和过多的胃酸
C. 屠呦呦用乙醚从青蒿中提取出对治疗疟疾有特效的青蒿素,该过程包括萃取操作
D. PM2.5 是指粒径不大于 2.5μm 的可吸入颗粒物,其分散于大气后一定形成胶体
难度: 中等查看答案及解析
-
下列变化与氧化还原反应无关的是( )
A. 葡萄糖为人类生命提供能量时,化学能转化成热能
B. NaOH 溶液滴入 FeSO4 溶液中,先产生白色沉淀,随后变为红褐色,
C. 二氧化碳使过氧化钠固体变白
D. 中国古代人民利用天然磁石磨制最早的指南针——司南
难度: 中等查看答案及解析
-
清初《泉州府志》记载:“初,人不知盖泥法,元时南安有黄长者为宅煮糖,宅垣忽坏,去土而糖白, 后人遂效之。”下列选项中与文中“盖泥法”的原理相同的是( )。
A. 从地沟油中蒸馏出植物油
B. 实验室制备乙酰苯胺晶体(白色)时,在粗品中加入活性炭以除去有色杂质
C. 在腌制风味独特的咸鸭蛋时,要在蛋壳外均匀包裹一层黄泥
D. 用过滤法除去河水中的泥沙
难度: 中等查看答案及解析
-
下列变化中需加氧化剂才能实现的是( )
A. HCO3- CO32- B. K2CrO42- K2Cr2O72- C. I- I2 D. CO2 C
难度: 中等查看答案及解析
-
下列说法正确的是( )
A. 在氧化还原反应中,非金属单质一定做氧化剂
B. 氧化还原反应的本质是元素的化合价发生升降
C. 化合物所含的某种元素处于其最高价态,此化合物不一定具有强氧化性
D. 元素的单质只能由还原该元素的化合物制得
难度: 中等查看答案及解析
-
下列关于金属的说法不正确的是( )
A. 钠在空气中燃烧时,先熔化,再燃烧,生成淡黄色固体
B. 铝是地壳中含量最多的金属元素,铝在空气中受热熔化,剧烈燃烧
C. 铁在潮湿的空气中生成的氧化物疏松多孔,无法保护内层金属
D. 商代后期铸造出工艺精湛的后(司)母戊鼎,该鼎的用料属于有色金属材料
难度: 中等查看答案及解析
-
NA 是阿伏加德罗常数的值,下列说法正确的是( )
A. 标准状况下,22.4L 以任意比例混合的 H2 和 CO 中所含原子总数为 2NA
B. 由 32.50g FeCl3 制得的 Fe(OH)3 胶体粒子数为 0.2 NA
C. 常温常压下,Na 与 H2O 反应生成 11.2L H2,反应中转移的电子数为 NA
D. 常温常压下,质量均为 16g 的 O2 和 O3 中,电子数分别是 8NA 和 12NA
难度: 中等查看答案及解析
-
氯气是一种重要的化工原料,可用于自来水消毒。1868年,狄肯等科学家发明了在氯化铜催化并加热的条件下,利用空气中的氧气氧化氯化氢制取氯气的方法,译为地康法。其原理可表示为4HCl+O2
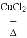 2H2O+2Cl2,下列说法正确的是()
2H2O+2Cl2,下列说法正确的是()A. Cl2是还原产物
B. 生成11.2LCl2(标准状况),转移电子数目为2NA
C. 反应中Cl被氧化,HCl得到电子
D. 氧化性:O2>Cl2
难度: 中等查看答案及解析
-
12mL1.0 mol/L 的 K2SO3 溶液恰好与 20mL 0.4 mol/L 的 KXO4 溶液完全反应。已知 K2SO3 被氧化为K2SO4,则 X 元素在还原产物中的化合价为( )
A. +1 B. +2 C. +3 D. +4
难度: 中等查看答案及解析
-
下列关于钠的化合物的说法中不正确的是( )
①热稳定性:Na2CO3>NaHCO3
②Na2O 和 Na2O2 都能与水反应生成碱,故均为碱性氧化物
③与盐酸反应的剧烈程度:Na2CO3>NaHCO3
④Na2O 和 Na2O2 晶体中阴、阳离子的数目比相同,均为 1:2
⑤Na2CO3 粉末遇水会生成含结晶水的晶体,其化学式可能为 Na2CO3·7H2O
⑥等质量的固体与足量盐酸反应放出的气体的体积:Na2CO3>NaHCO3
⑦分别向 Na2CO3 和 NaHCO3 的水溶液中滴加 BaCl2 溶液,均可产生白色沉淀
A. ②③⑥⑦ B. ①②③④⑥ C. ②③⑤⑥⑦ D. ②④⑤⑦
难度: 中等查看答案及解析
-
加入铝粉后产生大量气泡的溶液中,一定不能大量共存的离子组是( )
A. Mg2+、Na+、SO42﹣、K+ B. CO32-、K+、NO3- 、CH3COO-
C. NH4+ 、HCO3- 、Na+ 、Cl- D. I-、Na+ 、K+、SO42-
难度: 中等查看答案及解析
-
已知反应:KClO3 6HCl=KCl 3H2 O+3Cl2 此反应中氧化产物与还原产物的物质的量之比为( )
A. 1:1 B. 3:1 C. 1:5 D. 5:1
难度: 中等查看答案及解析
-
下列指定反应的离子方程式正确的是( )
A. 向氢氧化钡溶液中加入稀硫酸: Ba 2+ + OH- + H+ + SO42- = BaSO4 +H2O
B. 向饱和碳酸钠溶液中通入二氧化碳: CO32 CO2 H2O 2HCO3
C. 向氯化铝溶液中滴加过量的浓氨水:Al3+ + 4NH3•H2O = AlO2- + 4NH4+ +2H2O
D. 澄清石灰水与过量碳酸氢钠溶液混合: Ca 2+ + 2HCO3- + 2OH- = CaCO3 +2H2O+CO32-
难度: 中等查看答案及解析
-
元素的价类二维图是我们学习元素及其化合物相关知识的重要模型和工具,它指的是以元素的化合价为纵坐标,以物质的类别为横坐标所绘制的二维平面图像。下图为铁元素的价类二维图,其中的箭头 表示部分物质间的转化关系,下列说法正确的是( )
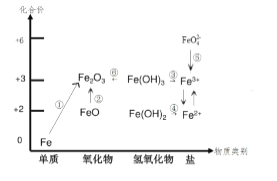
A. 铁与高温水蒸气的反应可实现上述转化①
B. FeO 是一种黑色粉末,不稳定,在空气中受热,迅速发生转化②生成红棕色粉末
C. 由图可预测:高铁酸盐( FeO42- )具有强氧化性,可用于消毒。FeO42- 与水反应最终可生成 Fe(OH)3胶体,从而吸附水中的悬浮物,故高铁酸盐可用做净水剂
D. 加热 Fe(OH)3 发生转化⑥,加水溶解可实现转化③
难度: 中等查看答案及解析
-
下列除去杂质的实验方法及操作正确的是( )
A. 除去 FeCl3 溶液中混有的 FeCl2:加入适量氯水
B. 除去 CO2 中混有的少量 CO:通入氧气,点燃,收集气体
C. 除去 Na2SO4 中混有的 Na2CO3:加入适量的稀盐酸
D. 除去 CuCl2 溶液中混有的 FeCl3:加入过量 Cu 粉后再过滤
难度: 中等查看答案及解析
-
某固体可能含有 Ba2+、NH4 + 、Cu2+、Na +、Cl -、CO32-、SO42-中的几种离子,取等质量的两份该固体,进行如下实验:
(1)一份固体溶于水得到无色透明溶液。加入足量的 BaCl2 溶液,得到沉淀 6.63g;在沉淀中加入过量 的稀盐酸,仍有 4.66g 沉淀。
(2)另一份固体与过量的 NaOH 固体混合后充分加热,产生气体 1.344L(标准状况)。已知NH4 + OH-=NH3↑H2O ,则下列说法正确的是( )
A. 该固体中一定只含有 NH4 + 、CO32-、SO42-
B. 该固体中一定没有Cu2+、Na +、Ba2+、Cl-
C. 该固体中一定含有NH4 + 、Na +、Cl -、CO32-、SO42-
D. 若该固体中含有 Na+,则一定含有 Cl-,且二者等量
难度: 中等查看答案及解析
-
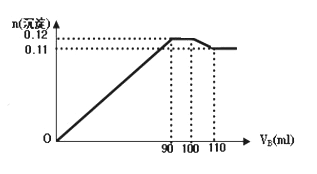
已知 2Fe2+ +Br2 = 2Fe3+ + 2Br-;2 Br- + Cl2 = Br2 + 2Cl-;2Fe3+ + 2I-= 2Fe2+ + I2。向 FeI2、FeBr2 的 混合溶液中通入 Cl2,溶液中某些离子的物质的量 n(离子)随通入 Cl2 的物质的量 n(Cl2)变化如图所示。则下列有关说法中不正确的是( )
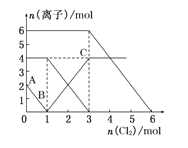
A. 还原性:I−>Fe2+>Br−
B. 原溶液中:n(Fe2+):n(I−):n(Br−)=2:1:3
C. 原混合溶液中 FeBr2 的物质的量为 6 mol
D. 当通入 2mol Cl2 时,溶液中已发生的离子反应可表示为:2Fe2++2I−+2Cl2═2Fe3++I2+4Cl−
难度: 中等查看答案及解析
-
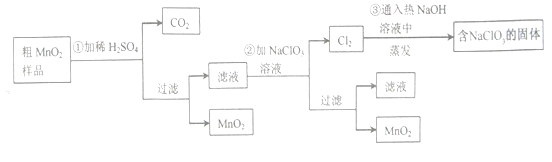
碱式氯化铜是重要的无机杀菌剂,有多种组成,可表示为 Cua(OH)bClc⋅xH2O。为测定某碱式氯化铜的 组成,进行下列实验:
(1)称取样品 1.1160g,用少量稀 HNO3 溶解后配成 100.00mL 溶液 A;
(2)取 25.00mL 溶液 A,加入足量 AgNO3 溶液,得 AgCl 0.1722g;
(3)另取 25.00mL 溶液 A,调节 pH 4∼5,用浓度为 0.08000mol⋅L−1 的 EDTA 标准溶液确定 A 中 Cu2+(原理为 Cu2++EDTA═EDTA−Cu2+),消耗 EDTA 标准溶液 30.00mL。通过计算确定该样品的化学式( )
A. Cu2(OH)2Cl2⋅3H2O B. Cu2(OH)3Cl⋅H2O
C. Cu(OH)Cl⋅2H2O D. Cu2(OH)Cl3⋅3H2O
难度: 中等查看答案及解析