-
化学产品在抗击新型冠状病毒的战役中发挥了重要作用,下列说法不正确的是
A.75%的医用酒精常用于消毒,用95%的酒精消毒效果更好
B.“84”消毒液的主要成分是次氯酸钠
C.用硝酸铵制备医用速冷冰袋是利用了硝酸铵溶于水快速吸热的性质
D.医用防护口罩中熔喷布的生产原料主要是聚丙烯,聚丙烯的单体是丙烯
难度: 简单查看答案及解析
-
我国科学家曾通过测量石英中26Al和10Be两种核素的比例确定“北京人”年龄,这种测量方法叫“铝铍埋藏测年法”。下列说法正确的是
A.10Be和9Be具有相同的化学性质,因此可以用9Be代替10Be完成“铝铍埋藏测年法”
B.BeCl2中Be、Cl原子最外层电子数都是8
C.世界卫生组织国际癌症研究机构公布的致癌物淸单中铝制品属一类致癌物,因此日常生活中要严禁使用铝制品
D.铍和铝在元素周期表中的位置特点决定了他们具有相似的化学性质,故氢氧化铍也为两性氢氧化物
难度: 简单查看答案及解析
-
中华优秀传统文化涉及到很多的化学知识。下列有关说法不正确的是( )
A.“自古书契多编以竹简,其用缣帛者(丝质品)谓之为纸”,这里的纸主要成分为纤维素
B.中国蓝是古代人工合成的蓝色化合物,其化学式为BaCuSi4O10,可改写成BaO·CuO·4SiO2
C.东汉魏伯阳在《周易参同契》中对汞的描述:“……得火则飞,不见埃尘,将欲制之,黄芽为根。”这里的黄芽是指硫
D.《天工开物》记载:“凡埏泥造瓦,掘地二尺余,择取无沙黏土而为之”。这里的瓦属于传统无机非金属材料,主要成分为硅酸盐
难度: 中等查看答案及解析
-
下列物质的分类正确的是( )
A.盐酸、冰醋酸、四氯化碳均为电解质
B.稀豆浆、硅酸、氯化铁溶液均为胶体
C.SO2、SiO2、NO2 均为酸性氧化物
D.福尔马林、水玻璃、氨水均为混合物
难度: 简单查看答案及解析
-
设NA为阿伏加德罗常数的值,下列叙述正确的是( )
A.6gSiO2晶体中含有的硅氧键数目为0.2NA
B.将0.1molCl2通入1L水中,充分反应后转移的电子数为0.1NA
C.常温常压下,10gD2O含有的质子数、电子数、中子数均为5NA
D.将含0.01molFeCl3的饱和溶液滴入沸水中可制得Fe(OH)3胶粒0.01NA
难度: 简单查看答案及解析
-
下列离子方程式中书写正确的是( )
A.在复盐 NH4Fe(SO4)2 溶液中逐滴加入Ba(OH)2 溶液,可能发生的反应离子方程式是:2Fe3 3SO
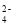 3Ba26OH3BaSO4 2Fe(OH)3
3Ba26OH3BaSO4 2Fe(OH)3B.Fe(NO)3 溶液中加入过量的 HI 溶液: 2Fe3 2I 2Fe2 I2
C.用银氨溶液检验乙醛中的醛基存在: CH CHO2[Ag(NH3)2 ] 2OH
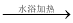 CH3COONH43NH32AgH2O
CH3COONH43NH32AgH2OD.FeBr2溶液中通入过量 Cl2: 2Fe22Br 2Cl2 2Fe3Br-2+4Cl
难度: 困难查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.NaCl
 Cl2(g)
Cl2(g)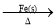 FeCl2(s)
FeCl2(s)B.N2(g)
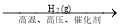 NH3(g)
NH3(g)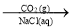 NaHCO3(s)
NaHCO3(s)C.AgNO3(aq)
 Ag(NH3)2OH
Ag(NH3)2OH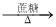 Ag(s)
Ag(s)D.S(s)
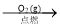 SO3(g)
SO3(g)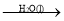 H2SO4(aq)
H2SO4(aq)难度: 中等查看答案及解析
-
关于下列三种常见高分子材料的说法正确的是( )
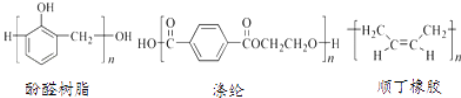
A.顺丁橡胶、涤纶和酚醛树脂都属于天然高分子材料
B.顺丁橡胶的单体与反—2—丁烯互为同分异构体
C.涤纶是对苯二甲酸和乙二醇通过缩聚反应得到的
D.酚醛树脂的单体是苯酚和甲醇
难度: 简单查看答案及解析
-
下列装置能达到实验目的的是
A.熔化Na2CO3
 B.验证SO2氧化性
B.验证SO2氧化性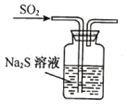
C.实验室制取NH3
 D.保存液溴
D.保存液溴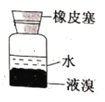
难度: 中等查看答案及解析
-
金属钾的冶炼可采用如下方法:2KFCaC2
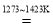 CaF22K2C,下列有关说法合理的是( )
CaF22K2C,下列有关说法合理的是( )A.该反应的氧化剂是KF,氧化产物是K
B.该反应能说明C的还原性大于K
C.电解KF水溶液不可能制备金属钾
D.CaC2、CaF2均为离子化合物,且阴、阳离子个数比均为2:1
难度: 简单查看答案及解析
-
氮及其化合物的转化过程如图所示。下列分析合理的是( )
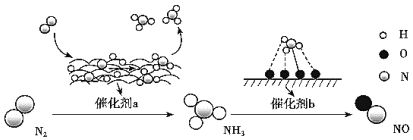
A.N2 与 H2 反应生成NH3 的原子利用率为 100%
B.催化剂a 表面发生了极性共价键的断裂和形成
C.在催化剂 b 表面形成氮氧键时,不涉及电子转移
D.催化剂 a、b 不仅能改变反应速率,还能提高反应的平衡转化率
难度: 中等查看答案及解析
-
曲酸和脱氧曲酸是非常有潜力的食品添加剂,具有抗菌抗癌作用,其结构如图所示。下列叙述错误的是
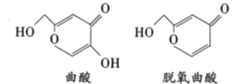
A.两物质都能使溴的四氯化碳溶液褪色
B.曲酸经消去反应可得脱氧曲酸
C.1mol脱氧曲酸最多能与3molH2发生加成反应
D.曲酸与脱氧曲酸中含有相同种类的官能团
难度: 中等查看答案及解析
-
下列实验中,所采取的分离方法与对应的原理都正确的是( )
选项
目的
分离方法
原理
A
分离氢氧化铁胶体和氯离子
盐析
胶体不能透过半透膜,离子能
B
分离植物油和水的混合物
分液
二者互不相溶且密度不同
C
除去苏打中少量小苏打
加热
二者的溶解度不同
D
除去乙酸乙酯中的乙醇和乙酸
蒸馏
乙酸乙酯与乙醇、乙酸的沸点相差较大
A.A B.B C.C D.D
难度: 中等查看答案及解析
-
某小组同学通过实验研究FeCl3溶液与Cu发生的氧化还原反应,实验记录如下表所示,下列说法错误的是( )
序号
Ⅰ
Ⅱ
Ⅲ
实验步骤

充分振荡,加入2mL蒸馏水

充分振荡,加入2mL蒸馏水
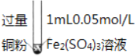
充分振荡,加入2mL蒸馏水
实验现象
铜粉消失,溶液黄色变浅,加入蒸馏水后无明显现象
铜有剩余,溶液黄色褪去,加入蒸馏水后生成白色沉淀
铜有剩余,溶液黄色褪去,变成蓝色加入蒸馏水后无白色沉淀
A.实验Ⅰ、Ⅱ、Ⅲ中均涉及Fe3+被还原
B.对比实验Ⅰ、Ⅱ、Ⅲ说明白色沉淀的产生可能与铜粉的量及溶液中阴离子种类有关
C.实验Ⅱ、Ⅲ中加水后c(Cu2+)相同
D.向实验Ⅲ反应后的溶液中加入饱和NaCl溶液可能出现白色沉淀
难度: 中等查看答案及解析
-
如图所示是探究某气体化学性质的实验装置,图中B为活塞。如先打开B,在A处通入干燥氯气,C中红色布条颜色无变化;当关闭B时,C中红色布条颜色褪去。则D瓶中盛有的溶液是( )
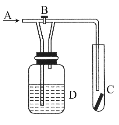
A.浓H2SO4 B.饱和NaCl溶液
C.NaOH溶液 D.NaBr溶液
难度: 中等查看答案及解析
-
工业上以铬铁矿(主要成分为FeO·Cr2O3)、碳酸钠、氧气和硫酸为原料生产重铬酸钠(Na2Cr2O7·2H2O),其主要反应为:
(1)4(FeOCr2O3)8Na2CO37O2
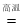 8Na2CrO42Fe2O38CO2
8Na2CrO42Fe2O38CO2(2)2Na2CrO4H2SO4Na2SO4Na2Cr2O7H2O
下列说法中正确的是( )
A.反应(1)和(2)均为氧化还原反应
B.反应(1)中FeO·Cr2O3既是氧化剂又是还原剂
C.高温下O2的氧化性大于Fe2O3小于Na2CrO4
D.生成1mol的Na2Cr2O7时转移7mol电子
难度: 中等查看答案及解析
-
工业上以铝土矿(主要成分为Al2O3,含Fe2O3杂质)为原料冶炼铝的工艺流程如下:
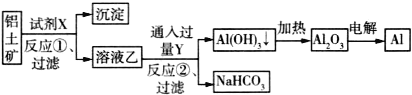
下列叙述正确的是( )
A.试剂X可以是氢氧化钠溶液,也可以是盐酸
B.反应①过滤后所得沉淀为氢氧化铁
C.反应②的化学方程式为NaAlO2+CO2+2H2O=Al(OH)3↓+NaHCO3
D.图中所有反应都不是氧化还原反应
难度: 中等查看答案及解析
-
向一定量的 Fe、FeO、Fe2O3、Fe3O4 的混合物中加入 300 mL 4 mol·L-1 的稀硝酸恰好使混合物完全溶解, 放出 4.48 L NO(标准状况),往所得溶液中加入 KSCN 溶液,无血红色出现。若用足量的H2 在加热条件下还原相同质量的混合物,则参加反应的 H2 物质的量为( )
A.0.1 mol B.0.2 mol C.0.3 mol D.0.4 mol
难度: 困难查看答案及解析

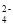 、NO
、NO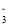 、Cl-
、Cl-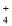 、Cu2+、Al3+
、Cu2+、Al3+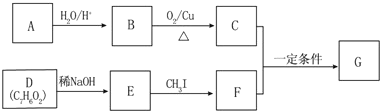
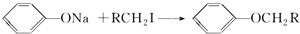
 RCOCH CHR
RCOCH CHR