-
化学与生活、生产、能源、环境和社会可持续发展等密切相关。下列说法正确的是
A.废旧电池属于有害垃圾,因含有重金属,故采用深挖填埋的方式进行处理
B.以高纯硅制成的光导纤维内窥镜可直接窥视有关器官部位的变化
C.“梨花淡自柳深青,柳絮飞时花满城”中柳絮的主要成分和棉花相同
D.国产大型客机C919上采用了大量先进复合材料、铝锂合金等,其中铝锂合金属于金属材料,是将金属铝、锂混合后在空气中熔合制得的
难度: 简单查看答案及解析
-
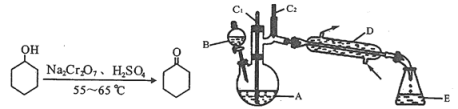
有机物G(
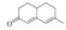 )能添加在牙膏、口香糖中以增强香气。下列关于G的说法错误的是( )
)能添加在牙膏、口香糖中以增强香气。下列关于G的说法错误的是( )A.分子式为C11H14O
B.一氯代物有8种(不考虑立体异构)
C.所有碳原子可能在同一平面上
D.能发生取代、加成、氧化反应
难度: 中等查看答案及解析
-
NA是阿伏加德罗常数的值,下列说法不正确的是
A.2gH2分别与足量的Cl2和N2充分反应后转移的电子数均为2NA
B.1.4gCO和N2的混合气体中含有的质子数为0.7NA
C.14.0gFe发生吸氧腐蚀生成Fe2O3·xH2O,电极反应转移的电子数为0.5NA
D.常温下,1L0.1mol·L1NH4NO3溶液中含有的氮原子数为0.2NA
难度: 中等查看答案及解析
-
用下列实验操作或装置进行相应实验,正确的是
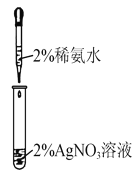
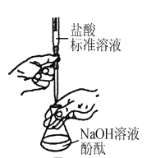
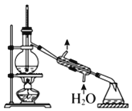
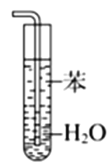
甲
乙
丙
丁
A.用图甲所示操作所示操作配制银氨溶液
B.用图乙所示操作测定NaOH溶液的浓度
C.用图丙所示操作分离沸点不同的液体混合物
D.用图丁所示操作吸收HC1气体,能够防止倒吸
难度: 中等查看答案及解析
-
短周期主族元素W、X、Y、Z的原子序数依次增加,K、L、M均是由这些元素组成的二元化合物,甲、乙分别是元素X、Y的单质,甲是常见的固体,乙是常见的气体。K是无色气体,是主要的大气污染物之一,0.05mol/L丙溶液的pH为l,上述物质的转化关系如图所示。下列说法正确的是
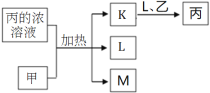
A.原子半径:W<X<Y
B.元素的非金属性:Z>Y>X
C.化合物XZ2中所有原子均满足8电子稳定结构
D.X、 Z的单质分别直接与Y的单质反应,都能生成两种氧化物。
难度: 中等查看答案及解析
-
某废水含Na+、K+、Mg2+、Cl-和SO42-等离子。利用微生物电池进行废水脱盐的同时处理含OCN-的酸性废水,装置如图所示。下列说法错误的是
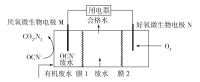
A.好氧微生物电极N为正极
B.膜1、膜2依次为阴离子、阳离子交换膜
C.通过膜1和膜2的阴离子总数一定等于阳离子总数
D.电极M的电极反应式为2OCN-6e+2H2O=2CO2↑+N2↑+4H
难度: 困难查看答案及解析
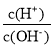 ]变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是( )
]变化如图所示(溶液混合时体积变化忽略不计)。下列说法不正确的是( )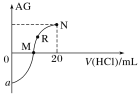
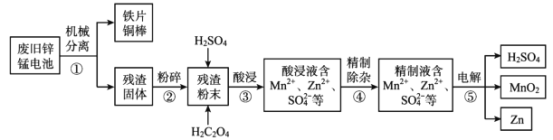
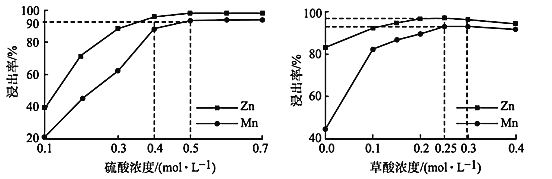
 2NH3(g)的活化能为508kJ/mol。则2NH3(g)
2NH3(g)的活化能为508kJ/mol。则2NH3(g)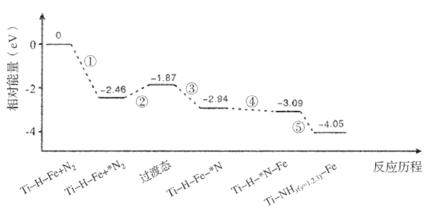
 N的断裂过程
N的断裂过程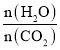 时,CO2的平衡转化率与氨碳比
时,CO2的平衡转化率与氨碳比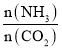 之间的关系。
之间的关系。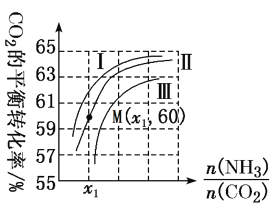
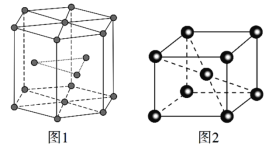
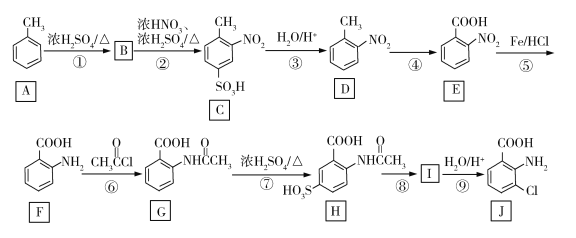
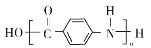 的合成路线。______________
的合成路线。______________