-
化学与生活密切相关。下列叙述错误的是
A.高纯硅可用于制作光感电池
B.SO2可用作食品的漂白剂
C.Na2O2可与CO2反应放出氧气,可用于制作呼吸面具
D.明矾可用于净水
难度: 中等查看答案及解析
-
已知NA为阿伏加德罗常数的值,下列叙述正确的是
A.1L0.1mol/LNH4Cl溶液中,
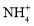 的数量为0.1NA
的数量为0.1NAB.0.1mol的14C中,含有0.6NA个中子
C.标准状况下,2.24LN2和O2的混合气体中原子数为0.2NA
D.16g甲烷和1mol白磷中含有的化学键数相等
难度: 中等查看答案及解析
-
下列化合物描述正确的是
A.苯乙烯(
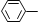 CH=CH2)所有原子一定在同一个平面上
CH=CH2)所有原子一定在同一个平面上B.
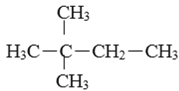 与CH3(CH2)4CH3互为同系物
与CH3(CH2)4CH3互为同系物C.
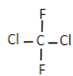 与
与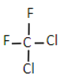 互为同分异构体
互为同分异构体D.HO-CH2CH=CHCH2-COOH可能发生加成、氧化和酯化反应
难度: 中等查看答案及解析
-
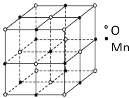
X、Y、Z、W均为短周期主族元素,原子序数依次增大,X的周期数等于原子序数,Z2-与W3+核外电子排布完全相同,四种元素原子序数之和为29。下列叙述正确的是
A.原子半径:W>Z>Y
B.由X、Y、Z三种元素形成的化合物可能含有离子键和共价键
C.简单氢化物热稳定性:Y>Z
D.四种元素均能呈现与其族序数相同的最高化合价
难度: 中等查看答案及解析
-
下列实验操作能达到实验目的的是
A.将饱和FeCl3溶液滴入沸水中至液体呈红褐色,停止加热制取氢氧化铁胶体
B.用铜棒与钢闸门相连,验证牺牲阳极的阴极保护法
C.将MgCl2溶液直接加热蒸干制备无水MgCl2
D.实验室配制稀硫酸时,先将浓硫酸加入烧杯中,后倒入蒸馏水
难度: 中等查看答案及解析
-
锌−空气燃料电池可用作电动车动力电源,电池的电解质溶液为KOH溶液,放电时反应为:2Zn+O2+4OH-+2H2O=2
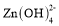 。下列说法正确的是
。下列说法正确的是A.放电时,正极反应为:Zn+4OH--2e-=
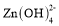
B.放电时,电路中通过2mol电子,消耗氧气22.4L(标准状况)
C.充电时,电解质溶液中c(OH-)逐渐增大
D.充电时,电子的运动方向为:电源负极→电解池阴极→电解质溶液→电解池阳极→电源正极
难度: 中等查看答案及解析
-
一定温度下,AgCl(s)⇌Ag+(aq)+Cl-(aq)体系中,c(Ag+)和c(Cl-)的关系如图所示。下列说法不正确的是
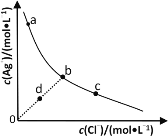
A.在AgCl溶于水形成的饱和溶液中:c(Ag+)=c(Cl-)
B.b点的溶液中加入少量AgNO3固体,会析出白色沉淀
C.d点溶液中加入少量AgCl固体,c(Ag+)和c(Cl-)均增大
D.a、b、c三点对应的AgCl的Ksp和溶解度皆不相等
难度: 中等查看答案及解析
 B(aq)+H2O(l) ΔH>0,物质A的初始浓度为0.180mol·L-1,测得物质B的浓度随时间变化的数据如表所示:
B(aq)+H2O(l) ΔH>0,物质A的初始浓度为0.180mol·L-1,测得物质B的浓度随时间变化的数据如表所示:
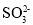 ):n(
):n(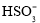 )变化关系如表:
)变化关系如表: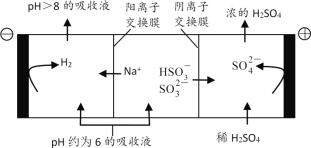
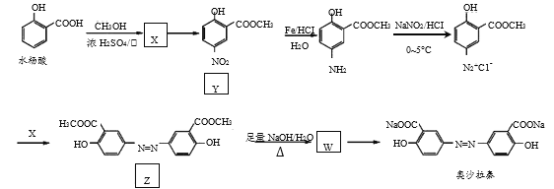
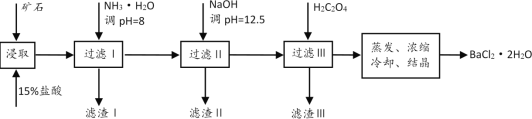
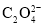 的浓度不低于__mol/L(离子浓度小于1×10-5mol/L时,认为沉淀就达完全);同时加入H2C2O4时又应避免过量,原因是__。(已知:KSP(BaC2O4=1.6×10-7,KSP(CaC2O4=2.3×10-9)。
的浓度不低于__mol/L(离子浓度小于1×10-5mol/L时,认为沉淀就达完全);同时加入H2C2O4时又应避免过量,原因是__。(已知:KSP(BaC2O4=1.6×10-7,KSP(CaC2O4=2.3×10-9)。