-
(1)对于反应2SiHCl3(g)===SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
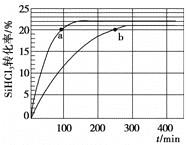
①343 K时反应的平衡转化率α=________%。平衡常数K343 K=________(保留2位小数)。
②在343 K下:要提高SiHCl3转化率,可采取的措施是________;要缩短反应达到平衡的时间,可采取的措施有________、________。
③比较a、b处反应速率大小:va________vb(填“大于”“小于”或“等于”)。反应速率v=v正-v逆=k正x2SiHCl3-k逆xSiH2Cl2xSiCl4,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算a处的v正/v逆=________(保留1位小数)。
(2)不同温度下水的离子积常数如表所示:
| t/℃ | 0 | 10 | 20 | 25 | 40 | 50 | 100 |
| Kw/10-14 | 0.114 | 0.292 | 0.681 | 1.01 | 2.92 | 5.47 | 55.0 |
①请用文字解释随温度升高水的离子积增大的原因 _______________;
②10℃时纯水的电离平衡常数为_________;计算100℃时纯水中电离产生的氢离子浓度为__________________。
-
三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,回答下列问题:
(1)SiHCl3在催化剂作用下发生反应:
2SiHCl3(g) = SiH2Cl2(g) + SiCl4(g) △H1 = +48 kJ/mol
4SiHCl3(g) = SiH4(g) + 3SiCl4(g) △H3 = +114 kJ/mol
则反应3SiH2Cl2(g) = SiH4(g) + 2SiHCl3(g)的△H=______________kJ/mol。
(2)对于反应2SiHCl3(g) = SiH2Cl2(g) + SiCl4(g),采用合适的催化剂,在323 K和343 K时SiHCl3的转化率随时间变化的结果如图所示。
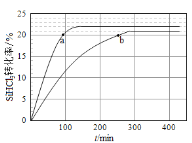
①323 K时反应的平衡转化率ɑ =______%。比较a、b处反应速率大小:υa_____υb(填“>”、“<”、“=”)
②在343 K下:要提高SiHCl3平衡转化率,可采取的措施是_______,要缩短反应达到平衡的时间,可采取的措施有_______。(两问均从下列选项中选择合适的选项填空)
A、增大反应物浓度
B、增大压强
C、及时将产物从体系分离
D、使用更高效的催化剂
③某温度(T K)下,该反应可使SiHCl3的平衡转化率达到30%,则该温度下的平衡常数KT K___K343 K(填“>”、“<”、“=”),已知反应速率υ=υ正-υ逆=k正x2(SiHCl3)-k逆x(SiH2Cl2)x(SiCl4),k正、k逆分别为正、逆向反应速率常数,x为物质的量分数,计算在该温度下当转化率为20%的时刻,υ正/υ逆=_____________(保留1位小数)。
-
三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,在催化剂作用下可发生反应:2SiHCl3(g) SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃时SiHCl3的转化率随时间变化的结果如图所示。下列叙述正确的是
SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃时SiHCl3的转化率随时间变化的结果如图所示。下列叙述正确的是

A.正反应方向为放热反应
B.反应速率大小:va <vb
C.70 ℃时,平衡常数K =
D.增大压强,可以提高SiHCl3的平衡转化率,缩短达平衡的时间
-
三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,在催化剂作用下可发生反应:2SiHCl3(g) SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。
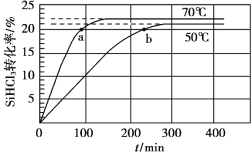
下列叙述不正确的是
A.该反应为吸热反应
B.反应速率大小:va >vb
C.70 ℃时,平衡常数K =0.112/0.782
D.增大压强,可以提高SiHCl3的平衡转化率,缩短达平衡的时间
-
三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,在催化剂作用下可发生反应:2SiHCl3(g) SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。
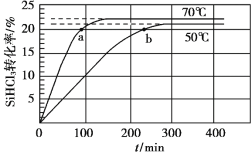
下列叙述不正确的是
A.该反应为吸热反应
B.反应速率大小:va >vb
C.70 ℃时,平衡常数K =0.112/0.782
D.增大压强,可以提高SiHCl3的平衡转化率,缩短达平衡的时间
-
在催化剂作用下,可逆反应2SiHCl3(g)⇌SiH2Cl2(g)+SiCl4(g)在温度为323K和343K时SiHCl2的转化率随时间变化的结果如图所示(已知:反应速率v=v正-v逆=k正 -k逆
-k逆 ,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数)。下列说法错误的是
,k正、k逆分别为正、逆向反应速率常数,x为物质的量分数)。下列说法错误的是
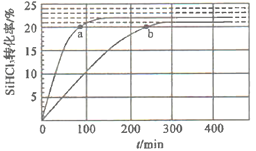
A.343K时,反应的平衡转化率为22%
B.343K时,反应的平衡常数约为0.02
C.323K时,提高反应物压强或浓度可缩短反应达到平衡的时间
D.a处的 1.1,且a处的反应速率大于b处的反应速率
1.1,且a处的反应速率大于b处的反应速率
-
三氯氢硅(SiHCl3)是制备硅烷、多晶硅的重要原料,在催化剂作用下可发生反应:2SiHCl3(g) SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。

下列叙述不正确的是
A.该反应为吸热反应
B.反应速率大小:va >vb
C.70 ℃时,平衡常数K =0.112/0.782
D.增大压强,可以提高SiHCl3的平衡转化率,缩短达平衡的时间
-
对于反应2SiHCl3(g) SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法不正确的是( )
SiH2Cl2(g)+SiCl4(g),采用大孔弱碱性阴离子交换树脂催化剂,在323K和343K时SiHCl3的转化率随时间变化的结果如图所示。下列说法不正确的是( )
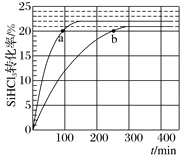
A.该反应的△H>0
B.a、b处反应速率大小关系:va大于vb
C.在343 K下,要提高SiHCl3转化率,可以及时移去产物或提高反应物浓度
D.343 K时,SiHCl3的平衡转化率为22%,可以求得该温度下的平衡常数约为0.02
-
一定温度下,在三个体积均为V L的恒容密闭容器中发生反应:2SiHCl3(g) SiH2Cl2(g)+ SiCl4(g)
SiH2Cl2(g)+ SiCl4(g)
| 容器编号 | 温度/K | 起始物质的量/mol | 平衡物质的量/mol |
| SiHCl3(g) | SiH2Cl2(g) | SiCl4(g) | SiHCl3(g) |
| Ⅰ | T1 | 1.0 | 0 | 0 | 0.80 |
| Ⅱ | T1 | 0.40 | a | a | 0.36 |
| Ⅲ | T2 (T2>T1) | 0.20 | 0 | 0 | 0.10 |
则:
(1)该反应的正反应为_________(选填“放热”或“吸热”)反应。
(2)表中a =________。
(3)在保持容器Ⅲ的实验条件下,若起始时充入0.40mol SiHCl3(g)、0.40 mol SiH2Cl2(g)、0.20mol SiCl4(g),则达平衡时容器中SiHCl3的物质的量为_________(请写出解题过程)
-
Ⅰ、已知:SiHCl3在催化剂作用下可发生如下反应:
2SiHCl3(g)=SiH2Cl2(g)+SiCl4(g) ΔH1=+48kJ·mol−1
3SiH2Cl2(g)=SiH4(g)+2SiHCl3(g) ΔH2=−30kJ·mol−1
(1)写出由SiHCl3(g)分解产生SiH4(g)和SiCl4(g)的热化学方程式为__。
Ⅱ、298K时,溶液中存在如下反应:A(aq) B(aq)+H2O(l) ΔH>0,物质A的初始浓度为0.180mol·L-1,测得物质B的浓度随时间变化的数据如表所示:
B(aq)+H2O(l) ΔH>0,物质A的初始浓度为0.180mol·L-1,测得物质B的浓度随时间变化的数据如表所示:
| t/min | 0 | 21 | 50 | 80 | 100 | 120 | 160 | 220 | 
|
| c/(mol·L-1) | 0 | 0.024 | 0.050 | 0.071 | 0.081 | 0.090 | 0.104 | 0.116 | 0.132 |
回答下列问题:
(2)该反应在50~80min内的平均反应速率为__mol·L−1·min−1。
(3)120min时A的转化率为__。
(4)298K时,该反应的平衡常数K=__,升温时平衡常数__(填“增大”、“减小”、或“不变”)。
(5)为提高A的平衡转化率,除适当控制反应温度外,还可采取的措施是__。
(6)下列叙述可说明可逆反应已达平衡的是__。
A.c(A)=c(B)
B.A和B反应速率相等
C.A和B的物质的量比值保持恒定
D.溶液的总质量保持恒定
 B(aq)+H2O(l) ΔH>0,物质A的初始浓度为0.180mol·L-1,测得物质B的浓度随时间变化的数据如表所示:
B(aq)+H2O(l) ΔH>0,物质A的初始浓度为0.180mol·L-1,测得物质B的浓度随时间变化的数据如表所示:






 SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。
SiH2Cl2(g)+SiCl4(g),在50 ℃和70 ℃ K时SiHCl3的转化率随时间变化的结果如图所示。
