-
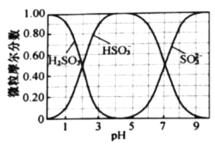
2020年“新冠”疫情在全球肆虐。下列说法不正确的是( )
A.酒精可以杀灭病毒是因为其能使构成病毒的蛋白质变性
B.研究表明,病毒可以通过气溶胶传播,气溶胶粒子的直径在
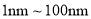 之间
之间C.口罩的核心材料熔喷布聚丙烯是一种有机高分子化合物
D.“84”消毒液的主要成分是HClO
难度: 中等查看答案及解析
-
用化学用语表示
 中的相关微粒,其中正确的是( )
中的相关微粒,其中正确的是( )A.中子数为1的氢原子:
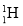 B.
B.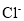 的结构示意图:
的结构示意图: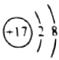
C.
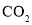 的比例模型:
的比例模型: D.
D.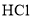 的电子式:
的电子式: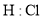
难度: 简单查看答案及解析
-
下列关于物质的性质与用途有对应关系的是( )
A.
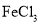 具有氧化性,可用于蚀刻印刷电路板
具有氧化性,可用于蚀刻印刷电路板B.
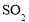 具有还原性,可用于漂白纸张
具有还原性,可用于漂白纸张C.
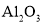 具有两性,可作高温耐火材料
具有两性,可作高温耐火材料D.
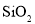 熔点高,可制作光导纤维
熔点高,可制作光导纤维难度: 简单查看答案及解析
-
常温下,下列各组离子在指定条件下能大量共存的是( )
A.
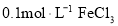 溶液中:
溶液中: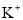 、
、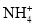 、
、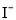 、
、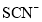
B.
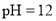 的溶液中:
的溶液中: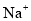 、
、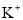 、
、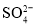 、
、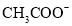
C.
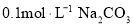 的溶液中:
的溶液中: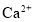 、
、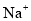 、
、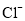 、
、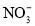
D.与
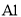 反应能产生大量氢气的溶液中:
反应能产生大量氢气的溶液中: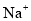 、
、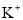 、
、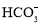 、
、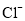
难度: 中等查看答案及解析
-
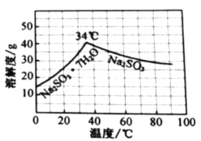
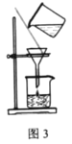
实验室模拟由“侯氏制碱法”制取Na2CO3,以下实验步骤能实现的是( )
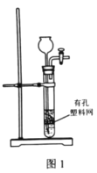

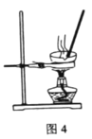
A.用图1装置由石灰石与稀盐酸制备CO2
B.用图2装置除去CO2中的HCl
C.用图3装置过滤所得的NaHCO3固体
D.用图4装置加热灼烧NaHCO3固体制Na2CO3
难度: 中等查看答案及解析
-
下列反应的离子方程式书写正确的是( )
A.
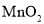 与浓盐酸反应:
与浓盐酸反应: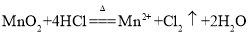
B.用惰性电极电解
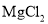 溶液:
溶液: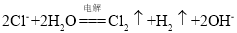
C.
 溶液与足量的
溶液与足量的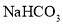 溶液反应:
溶液反应: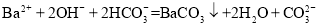
D.足量的
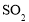 通入
通入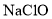 溶液中:
溶液中: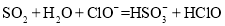
难度: 中等查看答案及解析
-
短周期主族元素X、Y、Z、W原子序数依次增加,X原子的半径小于Y原子,Y是地壳中含量最高的元素,Z原子的最外层只有1个电子,Y、W同主族。下列说法正确的是( )
A.原子半径:
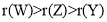 B.Y与Z形成的化合物中只含离子键
B.Y与Z形成的化合物中只含离子键C.W元素形成的最高价氧化物的水化物是强酸 D.X与Z形成的化合物中X为
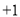 价
价难度: 中等查看答案及解析
-
在给定条件下,下列选项所示的物质间转化均能实现的是( )
A.
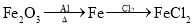
B.
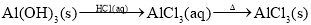
C.
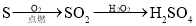
D.
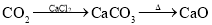
难度: 中等查看答案及解析
-
下列说法正确的是( )
A.反应
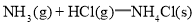 在室温下可自发进行,则该反应的
在室温下可自发进行,则该反应的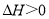
B.
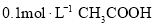 溶液加水稀释后,溶液中
溶液加水稀释后,溶液中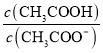 的值减小
的值减小C.若在海轮外壳上附着一些铜块,则可以减缓海轮外壳的腐蚀
D.
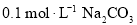 溶液中加入少量
溶液中加入少量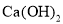 固体,
固体,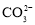 的水解程度减小,溶液的
的水解程度减小,溶液的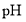 减小
减小难度: 中等查看答案及解析
-
室温下进行下列实验,根据实验操作和现象所得到的结论正确的是( )
选项
实验操作和现象
结论
A
向X溶液中滴加几滴新制氯水,振荡,再加入少量KSCN溶液,溶液变为红色
X溶液中一定含有Fe2+
B
向NaCl、NaI的混合稀溶液中滴入少量稀AgNO3溶液,有黄色沉淀生成
Ksp(AgI)<Ksp(AgCl)
C
向CuSO4溶液中加入铁粉,有红色固体析出
Fe2+氧化性强于Cu2+氧化性
D
用pH试纸测得:0.1mol·L-1CH3COONa溶液的pH约为9,0.1mol·L-1NaNO2溶液的pH约为8
Ka(CH3COOH)<Ka(HNO2)
A.A B.B C.C D.D
难度: 困难查看答案及解析
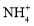 )>c(
)>c(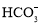 ),c(H2CO3)>c(NH3•H2O)
),c(H2CO3)>c(NH3•H2O)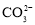 )
) 2CO(g) ∆H>0分别在一定温度下达到化学平衡状态。下列说法正确的是( )
2CO(g) ∆H>0分别在一定温度下达到化学平衡状态。下列说法正确的是( )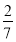
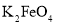 )是复合型的水处理剂,以废铁屑(含有
)是复合型的水处理剂,以废铁屑(含有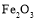 、
、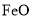 、油污等杂质)为原料制备的流程如下:
、油污等杂质)为原料制备的流程如下: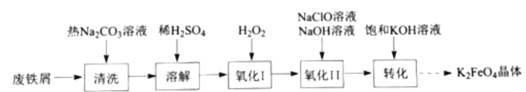
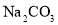 溶液清洗废铁屑的目的是_________。
溶液清洗废铁屑的目的是_________。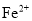 被氧化成
被氧化成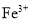 的离子方程式为________。
的离子方程式为________。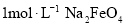 溶液在不同
溶液在不同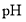 下,
下,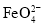 的浓度随时间的变化如图所示。氧化Ⅱ制备
的浓度随时间的变化如图所示。氧化Ⅱ制备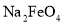 时,选用的加料方式是_________(填字母),原因是________。
时,选用的加料方式是_________(填字母),原因是________。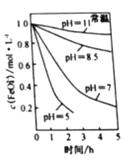
 、
、 混合液与氧化Ⅰ所得溶液同时加入到反应容器中
混合液与氧化Ⅰ所得溶液同时加入到反应容器中 溶液,析出
溶液,析出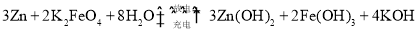 ,放电时正极的电极反应式为________。
,放电时正极的电极反应式为________。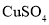 溶液和
溶液和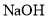 溶液混合制备
溶液混合制备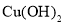 ,再将所得
,再将所得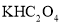 溶液混合,可制备草酸合铜酸钾晶体
溶液混合,可制备草酸合铜酸钾晶体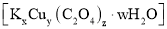 。通过下述实验确定该晶体的组成。
。通过下述实验确定该晶体的组成。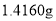 样品,放入锥形瓶,加入适量
样品,放入锥形瓶,加入适量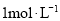 稀硫酸,微热使样品溶解,再加入
稀硫酸,微热使样品溶解,再加入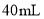 水加热,用
水加热,用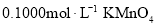 溶液滴定至终点,消耗
溶液滴定至终点,消耗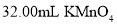 溶液。
溶液。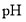 并加入过量
并加入过量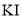 固体,与
固体,与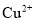 反应生成
反应生成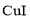 沉淀和
沉淀和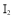 ,以淀粉作指示剂,用
,以淀粉作指示剂,用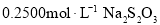 标准溶液滴定至终点,消耗
标准溶液滴定至终点,消耗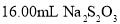 标准溶液。
标准溶液。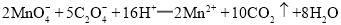 ;
;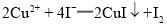 ;
;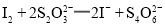
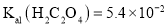 ,
,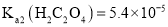 ,
,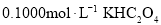 溶液
溶液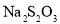 标准溶液的体积偏大,可能的原因有________(填字母)。
标准溶液的体积偏大,可能的原因有________(填字母)。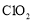 )具有强氧化性,
)具有强氧化性,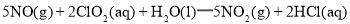

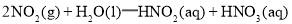
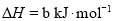
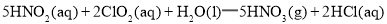
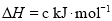
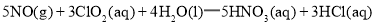 的
的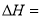 ________
________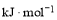
 对脱硫脱硝效率的影响分别如图所示,
对脱硫脱硝效率的影响分别如图所示,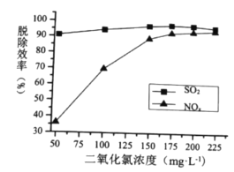
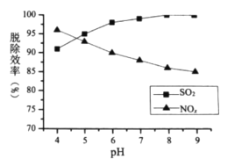
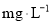 ;
;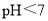 时,随着
时,随着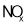 的脱除率下降,其可能的原因是__________
的脱除率下降,其可能的原因是__________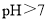 时,
时,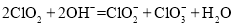 ,当有
,当有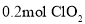 完全反应时,转移电子数目为________
完全反应时,转移电子数目为________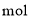 ;歧化反应生成的
;歧化反应生成的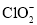 也可以作为氧化剂进行脱硝反应,写出碱性条件下
也可以作为氧化剂进行脱硝反应,写出碱性条件下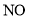 氧化为
氧化为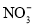 的离子方程式______________。
的离子方程式______________。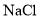 溶液制备
溶液制备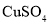 、
、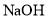 可以制备含有
可以制备含有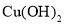 悬浊液,该悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米
悬浊液,该悬浊液可用于检验醛基,也可用于和葡萄糖反应制备纳米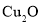 。
。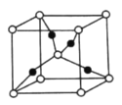
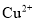 的核外电子排布式为__________。
的核外电子排布式为__________。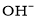 互为等电子体的一种分子为________(填化学式)。
互为等电子体的一种分子为________(填化学式)。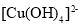 ,
,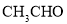 )中碳原子的轨道杂化类型是_________;
)中碳原子的轨道杂化类型是_________;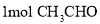 中含有
中含有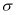 键的数目为________
键的数目为________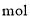 。
。 原子的数目为________。
原子的数目为________。 的步骤如下:
的步骤如下: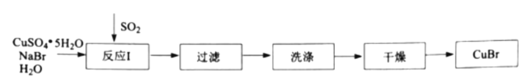
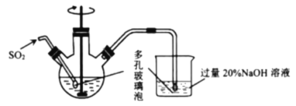
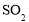 的水、溶有少量
的水、溶有少量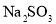 晶体。
晶体。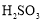 、
、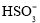 、
、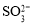 随
随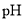 的分布,
的分布,